Inducerede pluripotente stamceller revolutionerer forskningen i neurodegenerative sygdomme

Sissel Ida Schmidt, Matias Jul Knudsen, Helle Bogetofte Barnkob & Morten Meyer
Inducerede pluripotente stam (iPS)-celler dannes ved reprogrammering af somatiske celler, og de kan, ligesom pluripotente embryonale stamceller, dele sig uendeligt og udvikle sig til enhver af kroppens ca. 230 forskellige celletyper.
iPS-cellekonceptet blev lanceret af japaneren Shinya Yamanaka i 2006, hvor han som den første påviste,
at det var muligt at omdanne fibroblaster fra mus til pluripotente stamceller [1]. I 2007 påviste han, at metoden kunne overføres til fibroblaster hos mennesker [2], og herefter spredte teknologien sig til store dele
af forskningsverdenen. I 2012 blev Yamanaka tildelt Nobelprisen i fysiologi og medicin for sine opdag-
elser.
Selvom iPS-celleteknologien er brugbar inden for næsten ethvert medicinsk forskningsområde, kan særligt forskningen i neurodegenerative sygdomme få glæde af teknikken. Det skyldes først og fremmest, at det inden iPS-cellens lancering ikke var muligt i laboratoriet at arbejde med levende nerveceller fra patienter. Studier af nervevæv fra patienter var således overvejende begrænset til patologisk væv, der langt oftest repræsenterer slutstadiet af sygdommen med lille mulighed for at forstå dens patogenese. Med iPS-cellerne er det nu muligt at producere og dyrke sygdoms- og patientspecifikke neuroner og gliaceller i laboratoriet. Dette muliggør molekylære undersøgelser af sygdomsmekanismer på levende celler og i et langt tidligere
udviklingsstadium end det hidtil har været muligt. Teknologien giver desuden mulighed for at screene potentielle lægemidler mod den pågældende sygdom direkte på nervecellerne og for at modellere sporadiske og genetisk komplekse sygdomme, som det ikke tidligere har været muligt at studere. Dette er i særdeleshed vigtigt for forskningen i neurodegenerative sygdomme, da kun 5-10% af alle patienter med f.eks. amyotrofisk lateral sklerose, Alzheimers sygdom og Parkinsons sygdom har arvelige, monogene varianter af sygdommene forårsaget af kendte mutationer [3, 4]. Netop de neurodegenerative sygdomme er omdrejningspunktet i stamcellekonsortiet BrainStem (www.brainstem.dk), som via støtte fra Innovationsfonden samler flere centrale aktører i dansk og svensk iPS-celleforskning.
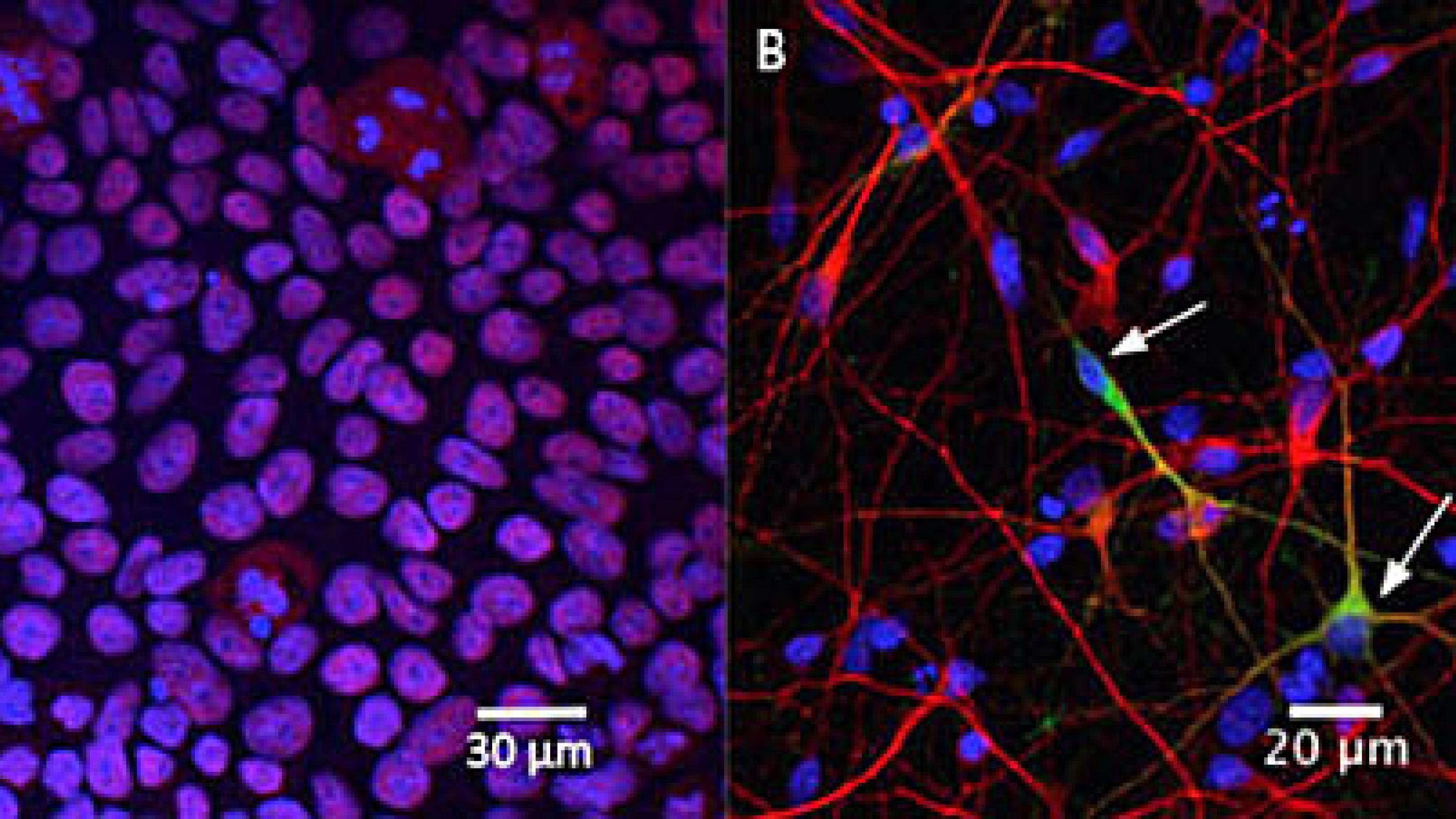
iPS-celler produceres ved reprogrammering af differentierede somatiske celler, f.eks. fibroblaster fra huden (Figur 1). Reprogrammeringen sker ved at tilføre bestemte pluripotensgener, som er aktive i embryonale stamceller, men som slukkes, når cellerne differentierer. Oprindeligt blev retrovirale vektorer anvendt til at udtrykke pluripotensspecifikke transkriptionsfaktorer, men teknologien er sidenhen blevet videreudviklet, så dette nu kan opnås uden brug af vira [5].
I den oprindelige metode, som blev lanceret af Yamanaka et al [1, 2], anvendte man transkriptionsfaktorerne c-Myc, Klf4, Oct3/4 og Sox2, men også denne del af teknologien har udviklet sig, så forskellige kombinationer af helt ned til to transkriptionsfaktorer (Oct4 og Sox2) nu kan anvendes [6]. Når først reprogrammeringen har fundet sted, kan iPS-cellerne opformeres i laboratoriet og holdes pluripotente ved tilførsel af de rigtige vækstfaktorer. Fjernes vækstfaktorerne fra dyrkningsmediet, vil cellerne spontant uddifferentieres til forskellige celletyper.
Med afsæt i neurobiologiske udviklingsstudier har man identificeret en række signalmolekyler og vækstfaktorer, der kan anvendes til differentiering af dyrkede iPS-celler i retning af bestemte neurale celletyper. Med denne viden er det nu muligt at tage en hudbiopsi fra en patient og reprogrammere fibroblasterne til iPS-celler, hvorefter de kan differentieres til den eller de celletyper, der ønskes undersøgt. Der findes en lang række eksempler på sådanne tiltag, herunder studier hvor fibroblastceller fra patienter med Parkinsons sygdom [7], amyotrofisk lateral sklerose [8] og spinal muskelatrofi [9] reprogrammeres til iPS-celler for dernæst at blive uddifferentieret til neuroner med henblik på undersøgelse af sygdomsmekanismer og test af lægemidler.
Før introduktionen af iPS-cellen var det kun muligt at danne pluripotente patientspecifikke stamceller ved brug af terapeutisk kloning. Her erstatter man cellekernen i en ægcelle med en somatisk cellekerne fra en patient. Det cytoplasmiske miljø i ægcellen vil herefter reprogrammere den somatiske cellekerne tilbage til et udifferentieret stadium. Efterfølgende lader man den manipulerede ægcelle dele sig, indtil den danner en blastocyst, hvorfra pluripotente patientspecifikke stamceller kan isoleres fra den indre cellemasse (Figur 1). Det at tilvirke humane embryoner ved kernetransplantation er kompliceret og begrænses desuden af behovet for egnede ægceller fra mennesker. Endvidere er der etiske problemer knyttet til brugen af klonede fosteranlæg, hvilket gør iPS-celleteknologien væsentligt mere attraktiv end den terapeutiske kloning [10].
IPS-cellernes anvendelsesmuligheder og perspektiver er mange (Figur 2) og udvikles til stadighed. Der introduceres løbende bedre differentieringsprotokoller og nye teknikker til manipulation af de genererede iPS-celler. Muligheden for at danne såkaldte isogene celler, iPS-cellelinjer, som er genetisk identiske på nær specifikke sygdomsrelevante mutationer, har gjort iPS-cellernes potentiale inden for sygdomsmodellering endnu større. Isogene iPS-cellelinjer kan dannes ved enten at inducere en mutation i en oprindeligt rask iPS-cellelinje eller ved at rette en mutation i en patientderiveret iPS-cellelinje. Nyere og nu etablerede redskaber til udførelse af sådanne genetiske modifikationer er såkaldte zinc-finger nucleases, transcription-activator-like effector nucleases og clustered regularly interspaced short palindromic repeats-Cas9 [11]. Metoderne muliggør selektive undersøgelser af effekten af en mutation i ét specifikt gen som f.eks. PARK2, der kan være muteret ved familiær Parkinsons sygdom [12], og som vi på Syddansk Universitet i øjeblikket har meget stort fokus på.
IPS-cellerne kan også anvendes til screening af nye lægemidler via teknikker, hvor de celler, som er relevante for sygdommen, behandles med et panel af forskellige stoffer. Denne teknik kræver store mængder af levende celler, som det med iPS-celleteknologien nu er muligt at producere. Metoderne muliggør endvidere undersøgelser på flere forskellige celletyper fra samme patient, således at der sideløbende med en lægemiddelscreening kan foretages prækliniske test af f.eks.
lever- og neurotoksicitet. Processen for lægemiddeludvikling formodes herved at kunne fremskyndes betydeligt, ligesom succesraten ved kliniske forsøg potentielt vil kunne forbedres ved på forhånd at have testet lægemidlerne i velvalgte raske og syge celler, der afspejler den patientgruppe, som lægemidlet sigtes mod.
En beskrivelse af iPS-celleteknologiens potentielle anvendelsesmuligheder bør også inkludere celleterapi, hvor degenererede celler erstattes af nye celler, eller hvor syge celler beskyttes gennem tilførsel af stoffer produceret af transplanterede celler [13]. Igennem 1980’erne og 1990’erne blev der udført en serie kliniske forsøg, der viste proof of concept vedrørende muligheden for at anvende umodne nervecelleforstadier fra føtalt hjernevæv til intracerebral transplantation hos patienter med Parkinsons sygdom og Huntingtons chorea [14-16]. Videre anvendelse af denne strategi har dog været hæmmet af vævsmangel, inkonsistent overlevelse eller funktion af de transplanterede nerveceller og etiske betænkeligheder forbundet med brugen af føtalt humant væv [17]. I igangværende kliniske forsøg (www.transeuro.org) sigter man derfor nu mod at forberede feltet på anvendelse af stamceller som et alternativ til føtalt væv. Brugen af stamceller som f.eks. embryonale stamceller eller neurale stamceller har den klare fordel, at cellerne kan opformeres inden brug, og kvaliteten af cellerne kan standardiseres, hvormed man sikrer et transplantat med højt indhold af de ønskede celler. Brugen af embryonale stamceller og neurale stamceller løser dog ikke de etiske problemer, og sådanne transplantationer kræver efter al sandsynlighed immunsuppressiv behandling af patienten. Med iPS-celleteknologien er det potentielt muligt at producere patientspecifikke neuroner til autolog transplantation uden væsentlig risiko for immunologisk afstødning.
I et af de første iPS-cellebaserede studier af sygdomsmekanismer reprogrammerede forskere fibroblastceller fra en patient med spinal muskelatrofi og fra patientens raske mor [9]. Studiet viste nedsat viabilitet af motorneuroner, som var lavet via de patientderiverede iPS-celler, og reduceret niveau af såkaldt survival of motor neuron (SMN)-protein i cellerne sammenlignet med motorneuroner produceret ved differentiering af de raske iPS-celler. Ved en efterfølgende screening blev det påvist, at SMN-proteinniveauet delvist kunne normaliseres ved behandling med valproat eller tobramycin. Studiet var på denne baggrund et af de første, hvor man kunne dokumentere iPS-celleteknologiens potentiale som platform til screening af lægemidler.
Det er ligeledes lykkedes forskere at fremstillet iPS-celler fra patienter med amyotrofisk lateral sklerose
[8] og differentiere disse celler til motorneuroner for dernæst at anvende dem til lægemiddelscreening. Screeningen førte til, at anacardic syre (en histonacetyltransferasehæmmer) i 2012 blev identificeret som et potentielt terapeutisk lægemiddel mod sygdommen [18].
I relation til Parkinsons sygdom har anvendelsen af iPS-celler bidraget med vigtig viden om menneskets dopaminerge nervecellers sårbarhed over for bestemte genetiske og miljømæssige påvirkninger. I undersøgelser af patientderiverede nerveceller har man koblet bl.a. proteinmisfoldning, oxidativt stress og lysosomal dysfunktion til sygdommens patogenese og samtidig trukket bånd til mutationer i gener som LRRK2, GBA og SNCA [19].
En umiddelbar udfordring ved at studere aldersrelaterede neurodegenerative sygdomme er, hvorvidt de iPS-cellederiverede nerveceller kan dyrkes længe nok til, at de udviser sygdomsafhængige fænotypiske forskelle. Dette er blevet adresseret på forskellig vis, herunder ved at udsætte cellerne for oxidativt stress eller ved genetisk introduktion af progerin for at fremme deres aldring [20, 21].
Andre neurologiske sygdomme, som er blevet modelleret ved brug af iPS-celler, er bl.a. familiær dysautonomi, Retts syndrom, skizofreni, Huntingtons chorea og Alzheimers sygdom [22].
Eksisterende protokoller bør stadig optimeres med henblik på at sikre en mere fuldstændig reprogrammering. Dette er vigtigt for at undgå fænotypisk variation på tværs af forskellige iPS-cellekloner som følge af f.eks. forskelle i antallet af genkopier, punktmutationer og unormal DNA-metylering, herunder også epigenetisk hukommelse, som kan influere på iPS-cellernes differentiering [22]. Disse problematikker er bl.a. relateret til brugen af integrerende virale vektorer under reprogrammeringen og overudtryk af onkogener som c-myc, der potentielt også vil kunne reaktiveres i iPS-cellederivaterne. I en lang række studier har man dog allerede adresseret disse problematikker, og det er nu muligt at anvende mere sikre, nonintegrerende metoder som adenovirus [23], sendaivirus [24], rekombinante proteiner [25] og episomale plasmider [26] til reprogrammering, ligesom tracersystemer er blevet lanceret til fjernelse af transgenerne, så snart cellerne er blevet pluripotente [27].
Fremtidige optimeringer af iPS-celleteknologien bør sikre en mere effektiv og sikker reprogrammering samt udvikling af billigere, mindre omfattende og mere standardiserede differentieringsprotokoller til produktion af homogene cellepopulationer. Hvis disse forbedringer opnås, vil teknologien utvivlsomt endnu mere end nu kunne bidrage til forståelsen af mekanismerne bag de neurodegenerative sygdomme og desuden måske kunne udgøre fundamentet for fremtidige autologe
celleterapier.
iPS-cellerne og de relaterede teknologier har revolutioneret vores mulighed for at afdække patogenesen bag de neurodegenerative sygdomme, herunder også muligheden for at identificere nye mål for potentiel medicinsk intervention. Selvom perspektiverne er enorme, er der fortsat problemstillinger, som skal udfoldes og adresseres, før metodernes fulde potentiale vil kunne udnyttes.
Korrespondance: Morten Meyer. E-mail: mmeyer@health.sdu.dk
Antaget: 10. maj 2016
Publiceret på Ugeskriftet.dk: 18. juli 2016
Taksigelse: Niels Knudsen takkes for kompetent hjælp med udarbejdelse af Figur 1 og Figur 2. Forfatterne takker desuden Innovationsfonden for den økonomiske støtte modtaget via etablering af stamcellekonsortiet BrainStem (www.brainstem.dk).
Interessekonflikter:
Research into the causes of neurodegenerative diseases like Parkinson’s- and Alzheimer’s disease has long been hampered by the lack of access to live disease-afflicted neurons for in vitro studies. The introduction of induced pluripotent stem (iPS) cells has made such studies possible. iPS cells can be reprogrammed from somatic patient-derived cells (e.g. skin cells) and differentiated into any cell type of the body. This allows for the production of neurons, which have the genetic background of the patients and show disease-relevant phenotypes.
Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell 2006;126:663-76.
Takahashi K, Tanabe K, Ohnuki M et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell 2007;131:
861-72.
Pasinelli P, Brown RH. Molecular biology of amyotrophic lateral sclerosis: insights from genetics. Nat Rev Neurosci 2006;7:710-23.
Nussbaum RL, Ellis CE. Alzheimer‘s disease and Parkinson‘s disease.
N Engl J Med 2003;348:1356-64.
Okita K, Nakagawa M, Hong H et al. Generation of mouse induced pluripotent stem cells without viral vectors. Science 2008;322:949-53.
Huangfu D, Osafune K, Maehr R et al. Induction of pluripotent stem cells from primary human fibroblasts with only Oct4 and Sox2.
Nat Biotechnol 2008;26:1269-75.
Soldner F, Hockemeyer D, Beard C et al. Parkinson‘s disease patient-derived induced pluripotent stem cells free of viral reprogramming factors. Cell 2009;136:964-77.
Dimos JT, Rodolfa KT, Niakan KK et al. Induced pluripotent stem cells generated from patients with ALS can be differentiated into motor neurons. Science 2008;321:1218-21.
Ebert AD, Yu J, Rose FF Jr. et al. Induced pluripotent stem cells from a spinal muscular atrophy patient. Nature 2009;457:277-80.
Han JW, Yoon YS. Induced pluripotent stem cells: emerging techniques for nuclear reprogramming. Antioxid Redox Signal 2011;15:1799-820.
Srikanth P, Young-Pearse TL. Stem cells on the brain: modeling neurodevelopmental and neurodegenerative diseases using human induced pluripotent stem cells. J Neurogenet 2014;28:5-29.
Kitada T, Asakawa S, Hattori N et al. Mutations in the parkin gene cause autosomal recessive juvenile parkinsonism. Nature 1998;
392:605-8.
Zhang ZG, Chopp M, Neurorestorative therapies for stroke: underlying mechanisms and translation to the clinic. Lancet Neurol 2009;8:491-500.
Bjorklund A, Dunnett SB, Brundin P et al. Neural transplantation for the treatment of Parkinson‘s disease. Lancet Neurol 2003;2:437-45.
Bachoud-Levi AC. Neural grafts in Huntington‘s disease: viability after 10 years. Lancet Neurol 2009;8:979-81.
Lindvall O, Kokaia Z, Martinez-Serrano A. Stem cell therapy for human neurodegenerative disorders-how to make it work. Nat Med 2004;
10(suppl):S42-S50.
Lindvall O, Bjorklund A. Cell therapeutics in Parkinson‘s disease. Neurotherapeutics 2011;8:539-48.
Egawa N, Kitaoka S, Tsukita K et al. Drug screening for ALS using patient-specific induced pluripotent stem cells. Sci Transl Med 2012;
4:145ra104.
Korecka JA, Levy S, Isacson O. In vivo modeling of neuronal function, axonal impairment and connectivity in neurodegenerative and neuropsychiatric disorders using induced pluripotent stem cells. Mol Cell Neurosci 2016;73:3-12.
Cooper O, Seo H, Andrabi S et al. Pharmacological rescue of mitochondrial deficits in iPSC-derived neural cells from patients with familial Parkinson‘s disease. Sci Transl Med 2012;4:141ra90.
Miller JD, Ganat YM, Kishinevsky S et al. Human iPSC-based modeling of late-onset disease via progerin-induced aging. Cell Stem Cell 2013;
13:691-705.
Xu XH,Zhong Z. Disease modeling and drug screening for neurological diseases using human induced pluripotent stem cells. Acta Pharmacol Sin 2013;34:755-64.
Zhou W, Freed CR. Adenoviral gene delivery can reprogram human fibroblasts to induced pluripotent stem cells. Stem Cells 2009;27:2667-74.
Fusaki N, Ban H, Nishiyama A et al. Efficient induction of transgene-free human pluripotent stem cells using a vector based on Sendai
virus, an RNA virus that does not integrate into the host genome.
Proc Jpn Acad Ser B Phys Biol Sci 2009;85:348-62.
Zhou H, Wu S, Joo JY et al. Generation of induced pluripotent stem cells using recombinant proteins. Cell Stem Cell 2009;4:381-4.
Afanasiev S, Aidala C, Ajitanand NN et al. Measurement of direct photons in Au+Au collisions at radical(s(NN))=200 GeV. Phys Rev Lett 2012;109:152302.
Kaji K, Norrby K, Paca A et al. Virus-free induction of pluripotency and subsequent excision of reprogramming factors. Nature 2009;458:
771-5.