Transplantation af kryopræserverede kardiovaskulære homografter

Margrete Stenehjem1, Dorte Kinggaard Holm2, Lars Riber1, Christian Nielsen2, Sara Schødt Riber1, Cengiz Akgül1 & Jes S. Lindholt1
Hovedbudskaber
Kar- og hjertekirurger har sammen med kliniske immunologer på Odense Universitetshospital (OUH) i 2019 taget initiativ til at oprette Skandinaviens første kardiovaskulære homograftbiobank (Figur 1). I denne artikel redegør vi kort for baggrunden for dette initiativ.
En kardiovaskulær homograft (allograft) er en transplanteret hjerteklap eller blodåre fra et andet menneske. De første humane anvendelser af homografter er beskrevet helt tilbage i 1906 [1], men kom reelt først til anvendelse, efter at Fontaine & Leriche grundlagde den første homograftbiobank til klinisk brug i 1951. Dubost benyttede sig straks af det og erstattede et abdominalt aortaaneurisme (AAA). Nyheden tog verden med storm. Fremtrædende karkirurger som DeBakey og Szilagyi tilegnede sig hurtigt proceduren, og biobanker med frosne homografter blev etableret. I 1952 blev en patient indlagt i New York med et bristet AAA, og da homograftbiobanken var tom, syede dr. Voorhees hastigt et rørtransplantat af en faldskærm fra 2. verdenskrig og implanterede det succesfuldt. Man tilbød herefter operationen til bl.a. Nobelpristageren Albert Einstein, som afslog og døde i 1955 af et bristet AAA [2]. Industrien startede produktion af kunstige blodårer af f.eks. Dacron og Teflon – sidstnævnte som produktudvikling af stoffet i Apollo 11-astronautdragterne. Senere blev også kunstige hjerteklapper udviklet og foretrukket. Man introducerede herved også en ny og frygtet komplikation: proteseinfektion.
Konservativ antibiotisk behandling kan ikke fjerne den inficerede omkringliggende biofilm, men højst holde infektionen i ave, så kirurgisk behandling er eneste kurative mulighed. Det sker oftest ved udskiftning med et lignende implantat, som selvsagt er behæftet med forøget infektionsrisiko før eller siden. Homografter begyndte derfor igen at blive brugt, især i USA og Central- og Sydeuropa, dog begrænset til udskiftning af inficerede arterielle proteser, komplekse arterielle segmenter og læsioner eller dialyseadgange [1].
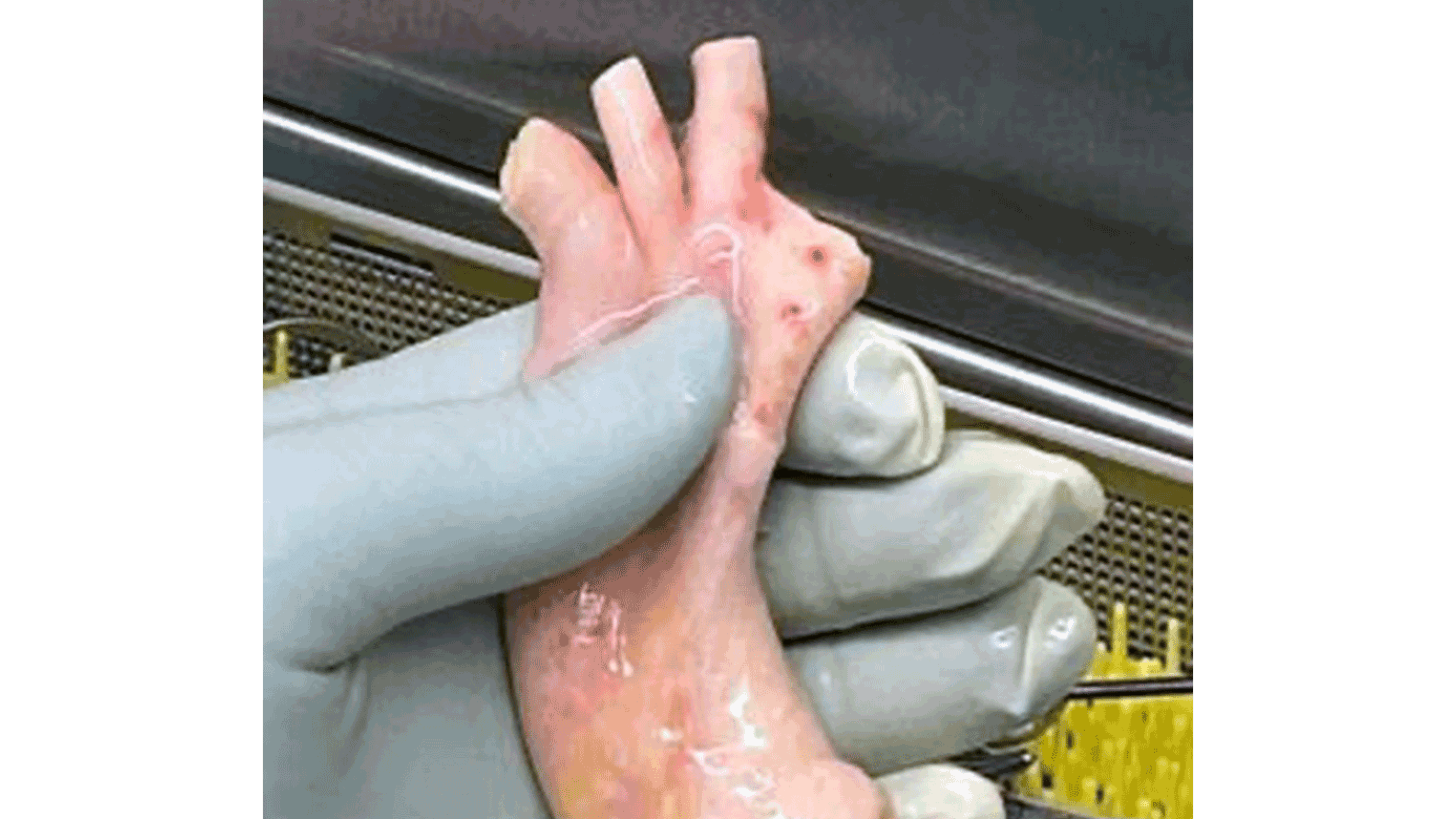
Allerede i 1950’erne stod det klart, at de frosne grafter hurtigt degenererede pga. vævskrystallisering under indfrysning, og først kort før årtusindskiftet blev der opdaget en hastighedsdifferentieret indfrysningsmetode i væske med antikrystalliseringsmidler, som bevarer cellernes vitalitet (Figur 2). Sidenhen er brugen steget markant med lovende resultater [3, 4], ja ligefrem så lovende, at de også er blevet anvendt til bypassoperationer på hjerte og ben.
Aortaklaphomograft
Der anvendes primært aortaklaphomografter evt. sammen med ascenderende aorta (Figur 2, Tabel 1). I en metaanalyse med 2.232 patienter fra 18 studier sammenlignede man homografter med kunstige hjerteklapper til behandling af aortaklapendokarditis og fandt ens overlevelse og ens hyppighed af reendokarditis og reoperation [6]. Et senere systematisk review og en metaanalyse af kompleks aortaklapendokarditisbehandling med homograft vs. andre alternativer viste en 30-dagesdødelighed på 17,9% vs. 19,4% (relativ risiko (RR) = 0,91), reinfektion 7,5% vs. 9,6% (RR = 0,89) og reoperation: 6,9% vs. 5,6% (RR = 0,91). Tallene er fortsat små, men viser en mulig risikoforskel på 10%. Society of Thoracic Surgeons anbefaler derfor homograft til patienter ved ekstensiv aktiv endokarditis med destruktion af aortaringen, og denne mulighed bør overvejes, hvor risiko for reinfektion er forøget [7].
Aortobiiliakal og aortobifemoral homograft
Aortobiiliakal og aortobifemoral homograft anvendes ved infektion af aorta (aortitis) og iliacapulsårene (mykotisk aneurisme) og central karproteseinfektion som erstatning af abdominal aorta og bækkenpulsårer. Der anvendes homografter af torakal-og abdominalaorta, iliaca communis og iliaca externa eller femoralarterier, som sys sammen til en bifurkationsprotese. Alle kombinationer er mulige.
Der er kun sparsom rapportering af nyere resultater efter udskiftning af ascenderende aorta, aortabuen og mykotisk aneurisme.
Erfaringerne med abdominal karproteseinfektion er dog efterhånden ganske betydelige. Af alle implanterede grafter bliver 0,3-5% inficeret [8]. De behandles på tre måder: 1) konservativt med livslang antibiotikabehandling. 2) Fjernelse af graften, blindlukning af aorta lige under afgangen af nyrearterierne, og ekstraanatomisk axillo(bi)femoral bypass (EAR). Det efterlader risiko for dødelig lækage af aortastumpen, og hos op mod 90% bliver der foretaget amputation inden for fem år [8]. 3) In situ-udskiftning af graften (ISR) med enten dybe femoralårer, kunststofproteser eller homografter. Udskiftning med en ny kunstig protese er behæftet med stor risiko for reinfektion, hvilket søges mindskes ved rifampicingennemvædning af protesen og/eller sølvbelagte proteser. Alternativt kan dybe femoralvener splejses sammen til en »vene-bukseprotese«, som er mere infektionsresistent. Det er dog en større operation, som kun tilbydes i selekterede tilfælde, og både faretruende aneurismedannelse eller stenoser ses med tiden.
En metaanalyse med 1.377 patienter, der fik indsat en homograft i form af ISR ved aortagraftinfektion, viste en 30-dagesdødelighed på 15%, graftrelateret kumuleret dødelighed på 3,6%, degeneration i 5% af tilfældene, ruptur i 6%, 25% reoperationer og 3,8% amputerede (Tabel 1) [5].
I to metaanalyser har man sammenlignet de kirurgiske behandlingsmetoder af hhv. 1.417 og 1.464 patienter [9, 10]. ISR var signifikant associeret med færre komplikationer, reinfektioner og dødelighed end EAR.
Der var ingen signifikant forskel i reinfektionshyppigheden mellem de forskellige ISR-transplantater (vener 2%; homografter 9%; rifampicinbundne eller sølvbelagte proteser 11%), men de viste alle signifikant bedre resultater end standardproteser. Signifikant færre blev amputeret ved brug af homografter (3%), rifampicinvædede grafter (3%) og sølvbelagte transplantater (4%) end ved brug af vener (9%). Ved standardproteser var der langt dårligere resultater i form af graftokklusion og amputation. Den 9% høje reinfektionsrate står i kontrast til 3% i ovennævnte metaanalyse [6] og skyldes formodentligt selektionsbias, ved at man i de inkluderede centre kun har brugt homografter i svære tilfælde og brugt mere tilgængelig og billigt kunststof ved knap så svære infektioner, hvorimod den ekstensive opgørelse inkluderer centre, der udelukkende har brugt homografter.
I et nyere multicenterstudie med 220 implanterede aortobiiliakale/femorale homografter fandt man en primær holdbarhed dvs. fungerende uden behov for assisterende indgreb på 97% efter fem år, hvilket faktisk svarer til primær implantering af kunstige grafter [11].
I de europæiske guidelines [8] anbefales dog fortsat primært rekonstruktion med egne dybe femoralvener, men man erkender, at indgrebet er meget omfattende og langvarigt, hvilket udelukker de ofte skrøbelige patienter, hos hvem der pragmatisk anbefales kryokonserverede homografter, sølvcoatede grafts eller rifampicinvædede polyestertransplantater, da de færreste råder over homograftmuligheden.
Dialysehomograft
En autolog arteriovenøs (AV) fistel er indiskutabelt at foretrække ved hæmodialyse, da eneste reelle alternativ er brug af en kunstig karprotese, fordi permanente i.v. dialysekatedre er forbundet med høj hyppighed af central veneokklusion, sepsis og overdødelighed. Den primære holdbarhed er dog blot omkring et års tid pga. proteseinfektion, operationskrævende blødning og trombose [12].
CryoLife, et amerikansk firma, påviste, at et- og toårsholdbarheden af 148 femorale venehomografer var hhv. 80% og 72% [13], mens den i tre uafhængige studier med i alt 125 patienter var 68-75% efter et år, hvilket er markant bedre end ved brug af kunstige proteser [14-16] og tæt på holdbarheden af en autolog AV fistel [12]. Infektionsraten i løbet af to år var 0-3%, mens den var ca. 25% ved brug af kunststofproteser [13-16]. Holdbarheden ved brug af homograft af lårets pulsåre er stort set ubeskrevet, ligesom brug af v. saphena magna (VSM) som homograft til dialyse.
Koronar og perifer arteriebypass
Der kan anvendes femorale arterier og dybe vener, samt VSM til koronar og perifer arteriebypass. Sidstnævnte er der størst erfaring med, hvor der rapporteres om et års primær holdbarhed på ca. 82% og 64% efter fem år ved perifer bypass. Det ikke meget dårligere end in situ-bypass med egen vene [17-21].
Erfaringerne med VSM til koronar bypass er mere beskedne. To studier har vist en etårsholdbarhed af 27 bypasser på 50% [22].
Fordelene og derved indikationerne for brug af homografter er således et bedre alternativ til kunststofproteser; enten ved brug i inficerede felter eller ved mangel på egne alternative blodårer.
En styregruppe bestående af læger og andet akademisk personale fra Hjerte-, Lunge- og Karkirurgisk Afdeling T samt Klinisk Immunologisk Afdeling (KIA) på Odense Uuniversitetshospital (OUH) implementerede i perioden 2019-2021 Skandinaviens første kardiovaskulære homograftbiobank. Etableringen var baseret på ekskursioner til andre europæiske vævsbanker foruden kommunikation og workshops med eksperter på området [23]. Et kvalitetsstyringssystem med versionsstyrede beskrivelser af alle standardprocedurer og et laboratorieinformationssystem (LIS) til registrering af de vaskulære homografter, donorer og recipienter blev udviklet ved at bruge allerede eksisterende systemer ved Syddansk Transfusionsvæsen og Vævscenter på KIA OUH. Begge opfylder kravene i EU-direktiverne om væv og celler. Til mærkning og identificering af alle homografter anvendes den internationale godkendte standard ISBT128.
Sygeplejersker og kirurger blev trænet i at udvælge donorer og i udtagningsprocedurerne for de kardiovaskulære homografter. Personale fra KIA blev uddannet i behandling, sterilisering, nedfrysning og kvalitetskontrol af vaskulære homografter. Der blev udført en validering af kvaliteten af graft før og efter kryopræservering herunder graftens sterilitet, vitalitet og tensometriske styrke og desuden validering af hele workflowet inklusive sporbarhed i LIS for både donor, graft og recipient. I marts 2021 blev homograftbanken på OUH af Styrelsen for Patientsikkerhed autoriseret til at udføre alle ovennævnte procedurer inklusive udlevering af homografterne til patientbrug.
Donorer udvælges iht. kriterierne i vævsloven af karkirurger på OUH. Samtykke indhentes af specialuddannede intensivsygeplejesker. Udtagning af blodkar foretages af transplantationskarkirurger i umiddelbar forlængelse af udtagning af organer til transplantation, og udtagningen af aorta ascendens, aortaklap og pulmonalklap varetages af en subspecialiseret hjertekirurg. Udtagne homografter placeres i individuelt mærkede sterile bøtter, som anbringes i en nedkølet (4 °C) transporttaske, der bringes til KIA.
I et renrumslaboratorie på KIA gennemgås de udtagne homografter efterfølgende med ekstra opmåling og kvalitetssikring af det udtagne væv, hvis dette ikke er foretaget i forbindelse med udtagningen. Vævsprøver fra alle kar homogeniseres og sendes til dyrkning for bakterier. Herefter placeres homografterne i en kommerciel bredspektret antibiotikavæske i tråd med behandlingen på andre europæiske centre.
Homografterne opbevares natten over (maks. 24 t.) i antibiotikavæsken, hvorefter de skylles, og en ny vævsprøve homogeniseres og sendes til dyrkning for bakterier. Homograften placeres i et frysemedie bestående af dyrkningsmediet RPMI-1640 og 10% dimethylsulfoxid i en mærket nedfrysningspose og nedfryses til –150 °C ved automatiseret temperaturstyret nedfrysning (Figur 1) i nitrogenindfrysningsapparatur og anbringes efterfølgende i gasfasen i en nitrogenbeholder.
Præoperativt: Efter indikation om modtagelse af en homograft er stillet og samtykket, indhentes informeret samtykke om tilladelse til brug af indhentning af journaldata. Præoperative blodprøver bestilles inkl. vævstypering.
Peroperativt: Under proceduren udtages prøver til dyrkning og resistens, og modtagerkar tilpasses for at kunne modtage homograften. Afskåret væv sendes til mikroskopi mhp. beskrivelse af vitalitet.
Postoperativt: Patienterne følger de retningslinjer, der er for hver enkelt procedure.
De hjertekirurgiske patienter følges med ekkokardiografi samt CT alt efter behov via Kardiologisk Afdeling på OUH. De karkirurgiske patienter kontrolleres med CT efter tre og 12 mdr., herefter årligt.
Korrespondance Margrete Stenehjem. E-mail: margrete.stenehjem@rsyd.dk
Antaget 16. januar 2024
Publiceret på ugeskriftet.dk 8. april 2024
Interessekonflikter Der er anført potentielle interessekonflikter. Forfatternes ICMJE-formularer er tilgængelige sammen med artiklen på ugeskriftet.dk
Referencer findes i artiklen publiceret på ugeskriftet.dk
Artikelreference Ugeskr Læger 2024;186:V07230454.
doi 10.61409/V07230454
Open Access under Creative Commons License CC BY-NC-ND 4.0
Due to degeneration, homografts were since the 1950s only used strictly for replacement of complex arterial segments and lesions incl. the aortic valve, replacement of infected arterial prostheses, and vascular access for patients on haemodialysis. During the 1990s, rate-differentiated freezing methods and anti-crystallization agents proved to prevent crystallisation, and more widespread use with expanded indications incl. coronary and lower limb bypasses began justified by promising midterm results. In 2021, the first Scandinavian homograft biobank was founded in Odense in Denmark. This review summarises the history and the experiences from this biobank.