Anstrengelsesudløst hedeslag

Louise Eggers Rasmussen1, 2 & Tintin Svensson3
Anstrengelsesudløst hedeslag er en livstruende tilstand, som ses i forbindelse med fysisk anstrengelse.
Hurtig erkendelse af tilstanden og aggressiv køling er essentielt for at reducere mortalitet og morbiditet.
Stigende interesse for motionsløb fordrer, at læger på tværs af sektorer har kendskab til tilstanden.
Anstrengelsesudløst hedeslag (EHS) er en livstruende tilstand, der kræver hurtig erkendelse og intervention [1]. EHS er en af de hyppigste årsager til uventet død under fysisk anstrengelse hos sportsudøvere og ses både blandt professionelle og motionsløbere [1-3]. I de fleste tilfælde af EHS-relaterede dødsfald er der tale om fejldiagnosticering og forsinket behandlingsstart. Med de seneste års stigende interesse for motionsløbsdeltagelse i Danmark, herunder halvmaraton og maraton, er kendskab til tilstanden afgørende. I denne artikel beskrives baggrunden for EHS, diagnostikken og den akutte behandling.
Hedeslag inddeles i to typer: 1) klassisk hedeslag [2] og 2) anstrengelsesudløst hedeslag. EHS differentieres hovedsageligt fra klassisk hedeslag ved at være betinget af muskelarbejde. Patienter med EHS karakteriseres således ved en triade af forudgående fysisk anstrengelse, en kernetemperatur, der typisk, men ikke altid, er højere end 40 °C, samt dysfunktion af centralnervesystemet (CNS) [4, 5].
EHS ses oftest hos unge, tidligere raske voksne. I litteraturen er tilstanden primært beskrevet i forbindelse med sportsrelateret fysisk anstrengelse, herunder amerikansk fodbold, motionsløb og ved militærtræning [6, 7]. I retrospektive opgørelser spænder incidensen af EHS fra 1,6 til 2,13 tilfælde pr. 1.000 løbsgennemførere ved langdistanceløb [4, 8], mens der ved Boston Marathon er rapporteret en incidens på 3,7 pr. 10.000 løbere [9].
Mortalitet efter EHS er associeret med varigheden af hypertermien snarere end graden deraf og estimeres at være op mod 26,5% [4, 10, 11]. Midlertidigt har studier vist, at overlevelsen nærmer sig 100% ved omgående og aggressiv behandling [2, 12].
Menneskets termoregulering styres af hypothalamus, og hos den normoterme er kernetemperaturen omtrent 36,0-37,5 °C. Ved fysisk anstrengelse produceres metabolisk varme i skeletmuskulaturen, der aktiverer termoreguleringsmekanismer. Den mest effektive er den sympathicusmedierede vasodilatation af kutane kar, som resulterer i en øget fordampning af sved fra hudens overflade. Når varmeproduktionen overstiger hastigheden for varmeafgift, er termoreguleringen inadækvat. Patofysiologien bag EHS formodes at involvere en række parallelt forløbende mekanismer.
Termoregulatorisk svigt
Hypertermi inducerer en række cellulære forandringer, der påvirker den cellulære homøostase. Proteindenaturering og -aggregering er blandt de initiale hypertermiske insulter ved temperaturer på 39-45 °C. Som respons på hypertermi aktiveres genetisk kodede termoregulatoriske mekanismer, herunder det såkaldte heat stress response (HSR). Der sker en opregulering af heat shock proteins, der stabiliserer proteomet op til en ikke aktuelt kendt temperaturtærskel [13]. Når responset svigter, progredierer overophedning til hedeslag.
Kardiovaskulært svigt
Ved fysisk anstrengelse ses et øget perfusionskrav til den arbejdende muskulatur under et samtidigt behov for varmeafgift. Dette medfører en stigning i cardiac output, og blodvolumen redistribueres til hud og muskulatur under en kompensatorisk reduktion af perfusionen til splanchnicusgebetet og nyrerne. Cellulær dysfunktion resulterer i en dekompensering, hvorved perfusionen til hud, muskulatur og hjerne falder.
Endotoksæmi
En konsekvens af nedsat perfusion til splanchnicusgebetet er iskæmisk reperfusionsskade af tarmepitelet. Epitelets tight junctions mister deres integritet, hvorved tarmbakterier og toksiner lækker fra tarmlumen til portalkredsløbet i den såkaldte »leaky gut hypothesis« [8, 14].
Systemisk inflammatorisk respons
Både hypertermi og endotoksæmi formodes at udløse et inflammatorisk respons ved aktivering af pattern recognition receptors i bl.a. neutrofilocytter og mononukleære celler. Dette frigiver pro- og antiinflammatoriske cytokiner, som udløser et systemisk inflammatorisk respons (SIRS) [8, 15].
Koagulopati
Frigivelsen af cytokiner i det systemiske kredsløb aktiverer det vaskulære endotel, koagulationskaskaden såvel som inhibering af fibrinolyse. Tab af endo- og epitelintegritet i øvrige organer, herunder mave-tarm-kanalen, formodes at bidrage til systemisk inflammation og dissemineret intravaskulær koagulation (DIC) [4, 8].
Risikofaktorer for udviklingen af EHS er velbeskrevne og kan inddeles i ekstrinsiske og intrinsiske faktorer.
Ekstrinsiske risikofaktorer
Ekstrinsiske risikofaktorer inkluderer varmt og fugtigt klima med en høj Wet Bulb Globe Temperature (WBGT)-værdi, suboptimal infrastruktur samt manglende kendskab til EHS hos det medicinske personale.
Wet Bulb Globe Temperature
WBGT er et varmeindeks, der beskriver omgivelsernes varmebelastning på mennesker via lufttemperatur, fugtighed, strålevarme og luftbevægelse. Der er en klar, lineær sammenhæng mellem høj WBGT-værdi og risikoen for udviklingen af EHS, og motionsløb implementerer i stigende grad WBGT-advarsler for deltagerne [7, 9].
Infrastrukturen
Infrastrukturen i relation til aktiviteten kan være afgørende for forebyggelse og behandling af EHS. Ved motionsløb vil dette f.eks. dreje sig om ruteplanlægning, væskedepoter, adgang til behandlingsområder og -ressourcer.
Intrinsiske risikofaktorer
De hyppigste intrinsiske risikofaktorer for EHS omfatter manglende varmeakklimatisering, nylig eller samtidig infektion, dehydrering, medicinforbrug og kompromitteret fysiologi.
Varmeakklimatisering
Varmeakklimatisering refererer til gradvis eksponering for varmere temperaturer eller trinvis øgning af den fysiske udholdenhed, hvormed termoreguleringsmekanismerne adapterer til de ændrede krav. Dette er særlig relevant for sportsudøvere, der skal være aktive i et varmere og fugtigere klima end deres sædvanlige. Vigtigheden eksemplificeres i rapporteringer om velakklimatiserede individer med kernetemperaturmålinger på 40-42 °C uden ledsagende EHS-symptomer [11, 16].
Infektion
Infektion, enten nylig eller aktiv på tidspunktet for fysisk anstrengelse, implicerer et aktiveret immunforsvar, hvorfor tærsklen for udviklingen af EHS formodes at være lavere [4, 8, 17].
Dehydrering
Dehydrering reducerer sensitiviteten af HSR, og stressresponset eksacerberes ved fysisk anstrengelse fra et hypohydreret udgangspunkt [18].
Medicinforbrug
Medicinforbrug kan inducere påvirkning af termoreguleringen og ses særligt ved forbrug af antipsykotika [19]. Kompromitteret barrierefunktion i mave-tarm-kanalen ved NSAID-anvendelse i forbindelse med længere løbedistancer er desuden velbeskrevet [16, 20].
Fysiologi
Individets fysiologiske status udgør en relevant betragtning for EHS-risikoen. Aldersmedieret reduktion i varmeafgiftsevnen, kompromitteret HSR samt adipositas er associeret med vanskeligere varmeafgift [4, 8, 21]. Der er ingen overbevisende evidens for forskellig risiko for udviklingen af EHS blandt mænd og kvinder.
Særlig unikt for EHS er effekten af individets motivationsniveau og drivkraft for at præstere. Ved maratonløb ses kollaps på baggrund af EHS hyppigst under den sidste fjerdedel af ruten og omkring målstregen [9], hvor særligt præstationsfaktorer presser løbere til grænsen for deres fysiske kapacitet. Dette medierer en tilbøjelighed til at negligere fysiske symptomer, og adfærden er associeret med yngre alder af løberen [22].
EHS ses i forbindelse med fysisk anstrengelse, og symptomerne inkluderer svær udmattelse, svimmelhed, kvalme, opkastninger, diarré, takykardi, hyperventilation og kollaps [10, 11, 23]. Hudfarve, -temperatur og -fugtighed er upålidelige indikatorer. CNS-dysfunktion er arketypisk for patientgruppen og omfatter ændret bevidsthedsniveau, konfusion, irritabilitet, agitation samt ataksi og er klassisk uden fokalitet [4, 23]. EHS-symptomer ligner dem, der ses ved andre anstrengelsesudløste tilstande såsom hyponatriæmi, hypotension og hypoglykæmi, hvorfor differentieringen kan være vanskelig. Patienterne kan have konkurrerende tilstande samtidig, og temperaturmåling er en essentiel adjunkt i differentialdiagnostikken.
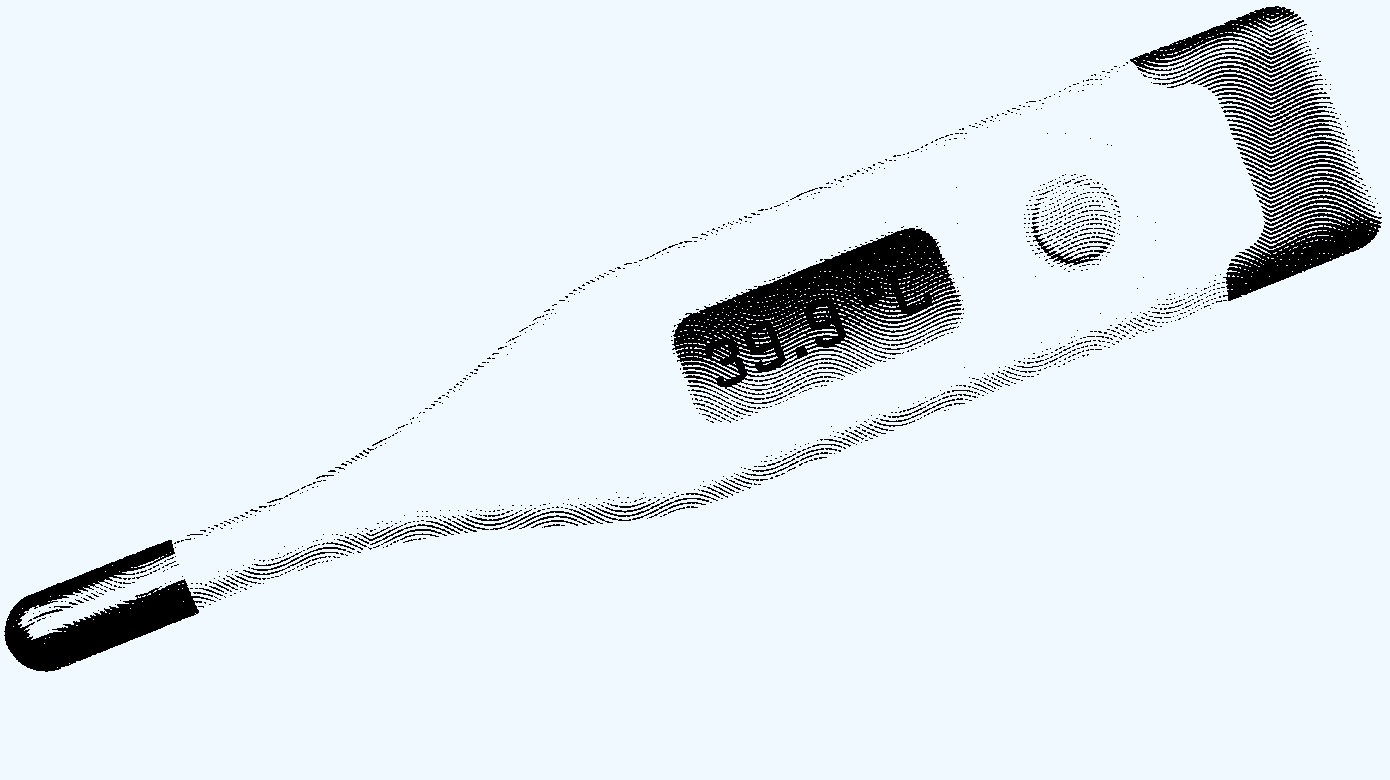
Triagering af den symptomatiske, og evt. kollapsede, sportsudøver følger standard ABCDE-principper. Ved den initiale gennemgang bør tidlig måling af rektaltemperatur hos den cerebralt påvirkede patient prioriteres. Orale, tympaniske og hudtemperaturmålinger er invalide målingsformer. Er rektaltemperaturen ≥ 40 °C, iværksættes behandling øjeblikkeligt. Da EHS kan manifestere sig ved temperaturer < 40 °C, må tilstedeværelsen af EHS-symptomer fortsat føre til køling under samtidig udredning af differentialdiagnoser.
Guldstandarden for behandlingen af EHS er tidlig erkendelse af tilstanden, aggressiv køling under kontinuerlig rektaltemperaturmåling, f.eks. vha. et rektaltermometer med lang probe, samt løbende monitorering af vitalparametre. En reduktion i kernetemperatur til < 39 °C inden for »den gyldne halve time« er hovedmålet for behandlingen, og paradigmet er »time is tissue« [23, 24]. Her nærmer mortaliteten sig nul, og 100% overlevelse er beskrevet i en større serie af patienter med EHS, hvor dette behandlingsmål blev opnået [2, 10, 21, 25].
En adækvat kølingsrate er minimum 0,15 °C pr. minut [2, 12, 21] med reevaluering hvert tiende minut. Den mest effektive kølingsteknik er nedsænkning af hele kroppen i koldt vand, såkaldt cold water immersion (CWI). CWI er logistisk udfordrende, hvorfor andre kølingsmetoder som isposer placeret over nakke, aksiller og lysker samt faciliteret evaporation af væske eller kølige, fugtige klæder på huden også er acceptabelt [4]. Valget af afkølingsmodalitet dikteres af den maksimale afkølingshastighed, der kan opnås ved de tilgængelige ressourcer. Således er EHS-behandlingen langs en løbsrute, i et behandlingstelt eller på en akutafdeling ressourcemæssigt forskellig [5]. Under igangværende køling af patienter med EHS ses ikke sjældent diarré, opkastning, kulderystelser og transient aggressivitet, hvor patienten kan blive kombattant. Responderer patienten tilfredsstillende på behandlingen, kan vedkommende efter en observationsperiode med acceptable vitale parametre hjemsendes til fortsat observation, rehydrering og advisering om lægekontakt ved ændring i almentilstanden eller anuri. Opnås derimod ikke tilfredsstillende bedring, bør transport til nærmeste sygehus planlægges, hvor avanceret understøttende behandling kan iværksættes. Her skal mantraet »cool first, transport second« kraftigt understreges, og alle patienter med EHS skal fortsætte køling under transport [2, 10, 12].
Den videre intrahospitale specialistbehandling er uden for denne artikels omfang. Behandlingsalgoritme for EHS præsenteres i Figur 1.
Akutte, alvorlige komplikationer til EHS omfatter rabdomyolyse, akut lever- og nyresvigt, SIRS, DIC og acute respiratory distress syndrome [5, 11, 15, 26]. Komplikationerne kan kulminere i multiorgansvigt, der i lighed med sepsis og større traumer kræver understøttende og evt. intensiv behandling [4].
Prognosen er gunstig ved tidlig og aggressiv behandling. Derimod øges risikoen for sequelae med varigheden af hypertermien [11, 27]. Studier indikerer, at 15% af patienterne oplever anstrengelsesrelateret varmeintolerance og endnu et EHS-tilfælde inden for de første to år efter første hændelse [11, 28, 29]. Øget incidens af kardiovaskulære hændelser, herunder myokardieinfarkt, iskæmisk hjertesygdom og kognitiv langtidspåvirkning, er ligeledes beskrevet [15, 23, 26, 30].
Tilbagevenden til fysisk aktivitet efter EHS kan være en bekymring hos sportsudøvere. American College of Sports Medicine har fremsat en række rekommandationer for gradvis reintroducering af fysisk aktivitet efter en asymptomatisk periode og tendens til normalisering af biokemi (Tabel 1) [11, 23]. Der er dog fortsat sparsom evidens for opfølgningsregimer og senkomplikationer, og fremtidig klinisk forskning på området ønskes.
EHS er en alvorlig og potentielt livstruende tilstand, der kræver hurtig erkendelse og intervention. Tilstanden ses i forbindelse med fysisk anstrengelse, primært hos unge, raske individer, og manifesterer sig klassisk ved hypertermi og CNS-dysfunktion. Aggressiv køling inden for den gyldne halve time er afgørende for mortalitet og morbiditet, hvor tilstanden ellers kan kulminere i multiorgansvigt og behov for intensivbehandling. Ved rettidig behandling er prognosen god, og dødsfald kan forebygges.
Korrespondance Louise Eggers Rasmussen. E-mail: louise.ida.eggers.oestergaard.rasmussen.01@regionh.dk
Antaget 5. maj 2025
Publiceret på ugeskriftet.dk 4. august 2025
Interessekonflikter ingen. Begge forfattere har indsendt ICMJE Form for Disclosure of Potential Conflicts of Interest. Disse er tilgængelige sammen med artiklen på ugeskriftet.dk
Referencer findes i artiklen publiceret på ugeskriftet.dk
Artikelreference Ugeskr Læger 2025;187:V03250144
doi 10.61409/V032500144
Open Access under Creative Commons License CC BY-NC-ND 4.0
Exertional heatstroke (EHS) is a life-threatening medical emergency characterized by severe hyperthermia, typically ≥ 40 °C, and central nervous system dysfunction. EHS occurs during physical exertion and is often exacerbated in hot and humid environments. Early recognition and rapid cooling to mitigate mortality and morbidity is critical. Delayed intervention may lead to multiorgan failure due to prolonged hyperthermia. Survival and recovery from EHS necessitate multidisciplinary efforts across prehospital care, advanced clinical management, and follow-up with primary care physicians, as argued in this review.