Benigne spytkirteltumorer

Tobias Bastian Ross Clemmesen, Bent Ivan Larsen & Gitte Bjørn Hvilsom
Alle spytkirteltumorer bør udredes med UL-vejledt finnålsaspiration.
Den primære behandling af de fleste benigne spytkirteltumorer er kirurgi.
Implementering af struktureret rapportering af kirurgisk tilgang kunne styrke evidensen på dette område.
Der diagnosticeres over 400 nye tilfælde af benigne spytkirteltumorer om året i Danmark [1]. WHO har rapporteret over 15 forskellige benigne spytkirteltumorer (Tabel 1) [2], hvoraf de to hyppigste er det pleomorfe adenom (PA) og Warthin’s tumour (WT) [3, 4, 6, 7]. Formålet med denne artikel er at beskrive forekomst, udredning og behandling af de hyppigst forekommende benigne spytkirteltumorer.
Ætiologien bag benigne spytkirteltumorer er ikke fuldt klarlagt [5]. Hypoteser om genetiske og miljømæssige faktorer har været undersøgt uden fund af endegyldig evidens [4], fraset, at WT er hyppigere hos mænd, der ryger, i alderen 40-70 år [8]. Generelt for benigne spytkirteltumorer er alderen ved diagnosetidspunktet oftest 40-80 år med en let øget forekomst hos kvinder [1, 3].
Størstedelen af de benigne spytkirteltumorer forekommer i glandula parotis (GP) (70%) [3], hvoraf 85-87% er lokaliseret i den superficielle lap, ca. 11% i den profunde lap og 1-4% i det accessoriske parotisvæv [4, 5]. Maligne tumorer udgør i GP 15-35% og i glandula submandibularis (GSM) ca. 50% [3, 6]. Sjældnere findes tumorer i de små spytkirtler og glandula sublingualis (GSL), hvor hhv. ca. 50% og 75% er maligne. Jo mindre spytkirtel, jo højere malignitetsrisiko ved fund af tumorer i de parrede spytkirtler [6, 9, 10]. Ganen er det hyppigste sted for benigne tumorer i de små spytkirtler, men tumorer findes også udgående fra øvrige steder i mundhulens, tungens, svælgets, næsens og bihulernes slimhinder [6, 10, 11].
Det PA er den hyppigste benigne spytkirteltumor udgørende 60-70%. Omkring 80% af disse ses i GP og hyppigst unilateralt [3]. Det PA blev oprindeligt kaldt »benign mixed tumour« grundet den blandede histologiske sammensætning af epiteliale, myoepiteliale og mesenkymale komponenter [3, 4]. Et PA kan blive ganske stort og har et lille malignt transformationspotentiale på ca. 1% pr. år [5, 7]. Der ses en stigende transformationsrisiko, jo længere tid et PA lades in situ, hvorfor kirurgisk behandling anbefales især hos yngre patienter.
Den næsthyppigste benigne spytkirteltumor er WT, også kaldet cystadenolymfom, der udgør ca. 17% [3, 5]. WT forekommer hyppigst i den kaudale pol af GP og ses bilateralt hos op til 10%. WT består af lymfocytter og onkocytært epitel og undergår så godt som aldrig malign transformation (< 0,1%) [12].
Der foretages et stigende antal FDG-PET-CT, hvilket har resulteret i et stigende antal spytkirtelincidentalomer. I et studie af Makis et al. fra 2013 [13] med 7.252 FDG-PET/CT havde 0,4% af patienterne opladning i GP. Af disse havde ca. 80% en regulær tumor i GP. 4% var maligne. Blandt de benigne tumorer med endelig cytologisk eller histologisk diagnose havde 40% WT. WT kan endog udvise højere optag på FDG-PET/CT end maligne spytkirteltumorer [13].
Benigne spytkirteltumorer vokser oftest langsomt og uden smerter med symptomer som kosmetiske gener, ubehag eller trykken [4]. Ved intraorale tumorer kan ses dysfagi, påvirket artikulation eller proteseproblemer [1, 10, 14]. Objektivt lægges vægt på inspektion og palpation af ansigt, hals og mundhule – med fokus på spytkirtlerne. Spytkirtlernes udførselsgange inspiceres, og afløbet herfra undersøges. Tilsvarende undersøges tumorstørrelse og konsistens, forstørrede lymfeknuder og funktion af nervus facialis (NF). Større tumorer i den dybe lap af GP kan medialisere lateralvæggen af oropharynx og fejltolkes som udfyldning omkring tonsillejet. Alle spytkirteltumorer bør udredes ved praktiserende øre-næse-hals-læge. Henvisningskriterierne til pakkeforløb udarbejdet til almen praksis ved spytkirteltumorer er [15]: 1) nytilkommen tumor i spytkirtel; 2) vækst i allerede diagnosticeret tumor i spytkirtel; 3) tumor i spytkirtel med påvirkning af ansigtsmimik, dvs. i NF.
Yderligere udredning
Spytkirtlernes superficielle beliggenhed gør UL-skanning til den primære billeddiagnostiske undersøgelse, om end den dybe lap af GP kan være svær at fremstille sufficient. Med UL beskrives tumorens lokalisation, form, struktur (cystiske og solide komponenter) og størrelse (måles i tre dimensioner). UL bør indbefatte halsens lymfeknuder i ipsilaterale level I-III [10]. UL-vejledt finnålsaspiration (FNA) bør foretages fra alle spytkirteltumorer for at afklare tumorens ætiologi [4, 5]. Egnetheden af denne afhænger af både operatørens og patologens erfaring hermed. Der er rapporteret positive og negative prædiktive værdier af FNA på hhv. 98% og 94% for benigne tumorer i GP [4], mens der er rapporteret sensitivitet på 83% og specificitet på 99% af FNA til diagnosticering af malignitet [5, 16]. En uegnet FNA bør altid gentages.
Ved mistanke om tumor i den dybe lap af GP, i de små spytkirtler eller i GSL bør MR-skanning foretages [5], så tumorlokalisation visualiseres, og relation til omkringliggende strukturer kan vurderes [17].
Der er konsensus om, at den primære behandling af benigne spytkirteltumorer er kirurgisk eksstirpation, dog kan observation vælges i udvalgte tilfælde [7, 9, 18-20]. Dette gælder f.eks. ældre patienter med PA, hvor der på baggrund af restlevetid kan være relativt lille malignitetsrisiko. Patientens ønsker og evt. komorbiditeter må også tages med i betragtning. Ved asymptomatiske WT’er bør observation ligeledes overvejes. Ved observation kræves stillingtagen til behovet for klinisk kontrol med UL i passende intervaller [8, 19].
Kirurgisk tilstræbes komplet tumorresektion, hvor nærliggende nerver skånes, og mest mulig rask kirtelvæv bevares [19]. Det anbefales at anvende intraoperativ nervemonitorering [21]. Kliniske indikationer for kirurgi inkluderer generende symptomer hos patienten, transformations- og vækstpotentiale og usikkerhed om cytopatologi [8].
Glandula parotis
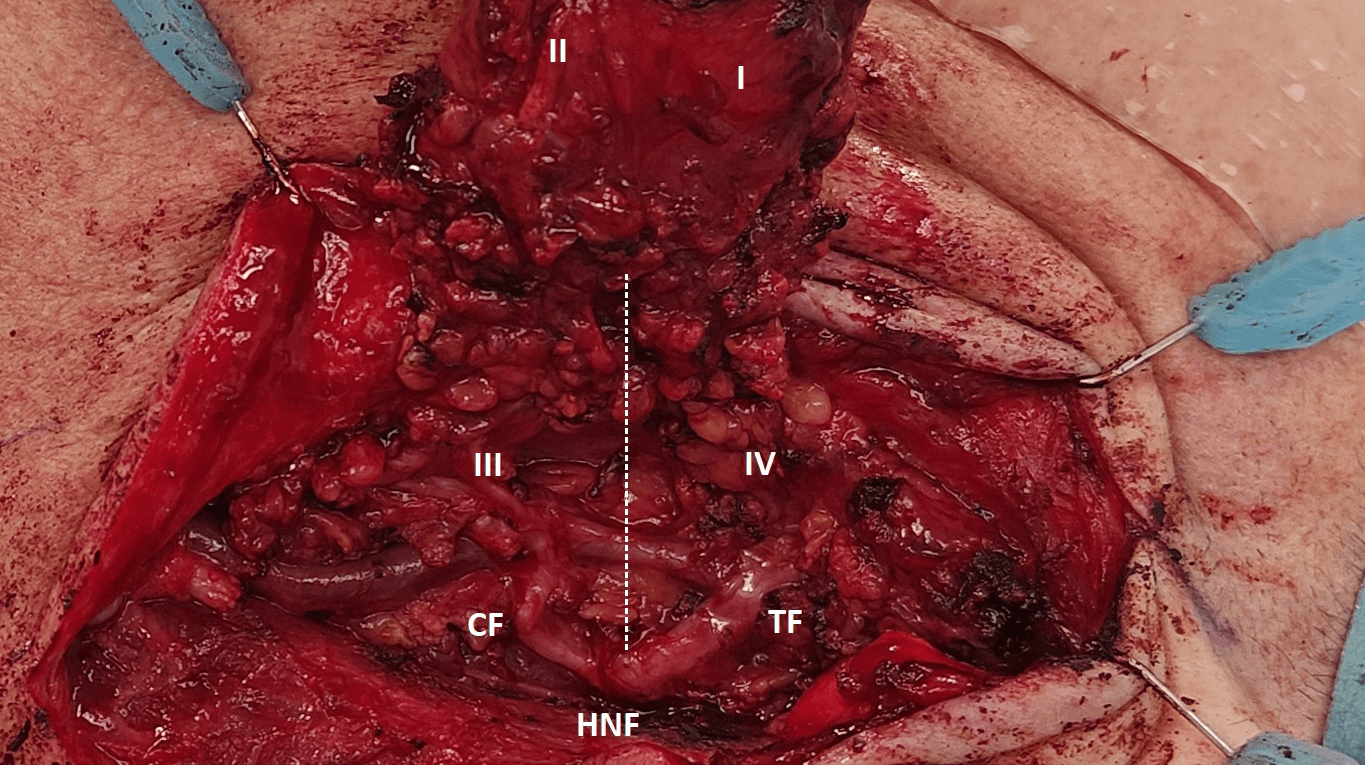
Parotiskirurgien har udviklet sig i de seneste 25 år mod mindre invasive teknikker [19], men der er ikke konsensus om omfanget af det kirurgiske indgreb i alle tilfælde [19, 22, 23]. I 2016 publicerede Den Europæiske Spytkirtel Gruppe (ESGS) et udkast til klassificering af behandling af benigne tumorer i GP, hvor de anatomiske forhold og tumorstørrelsen influerer på valg af kirurgisk teknik [20]. Målet var at skabe en systematiseret tilgang til den kirurgiske behandling og at bidrage til evidensbaseret forskning ved hjælp af standardiseret nomenklatur. Gruppen præsenterede ESGS-levels, der inddeler selve GP i fem levels (I-V) (Figur 1). Den kirurgiske behandling navngives ud fra den anvendte teknik og de ESGS-levels, der fjernes (Tabel 2).
Superficiel parotidektomi (SP) og partiel superficiel parotidektomi (PSP) er i mange centre de foretrukne behandlinger af tumorer i den superficielle lap af GP. Ved SP fjernes tumor og hele den superficielle lap ved frilægning af og dissektion langs NF og dens intraparotideale grene (level I og II, Figur 1). PSP defineres som frilægning af hovedstammen af NF og enten den temporofaciale eller cervicofaciale stamme afhængig af tumors placering (level I eller II, Figur 1).
Ved ekstrakapsulær dissektion (ECD) – som i Danmark ofte kaldes enukleation – søges tumor fjernet med 2-3 mm resektionsrande uden frilægning af NF’s hovedstamme. Dette anvendes i nogle centre hyppigere end SP og PSP til superficielle tumorer i GP [22]. Ved planlagt ECD kan der peroperativt opstå behov for at konvertere indgrebet og frilægge NF’s hovedstamme [19, 22]. Psychogios et al. [19] angiver, at spytkirtelkirurger bør have bred erfaring med SP og PSP, før der selekteres til ECD. Manglende kirurgisk erfaring må ikke bruges som argument for at vælge ECD frem for SP eller PSP [22].
Direkte sammenligning af de tre kirurgiske teknikker er svær, bl.a. på grund af usikkerhed om nomenklaturen. Flere studier har forsøgt at opgøre fordele og ulemper ved disse [19, 22, 23]. Der er rapporteret lavere risiko for midlertidig facialisparese og Freys syndrom ved ECD. Disse studier præges dog af selektionsbias, idet tumorerne, der selekteres til ECD generelt, er mindre end dem, der selekteres til SP [22, 23]. I et retrospektivt studie, der inkluderede 266 patienter opereret med enten PSP eller ECD, fandt man også signifikant lavere skade på n. auricularis magnus ved ECD. På baggrund af denne observation valgte dette center at indføre ECD som standardbehandling af superficielle WT’er [24].
Tumorer i den dybe lap forekommer hyppigere i den kaudale del af GP [20]. Ved én eller flere tumorer i den dybe lap eller med udstrækning hertil eller ved tumor med herniering til den stylomandibulære tunnel kan der foretages eksstirpation af den dybe lap eller subtotal/total parotidektomi [19, 20].
Intrakapsulær dissektion anses for at være obsolet særligt ved PA grundet stor risiko for tumorrecidiv, f.eks. ved efterladt tumorvæv eller pseudopodier, hvor recidivrater på 30-50% er rapporteret [19].
I den internationale litteratur, herunder i anbefalingerne fra ESGS, bruges begrebet enukleation synonymt med intrakapsullær dissektion og ikke ECD [19, 20].
Glandula submandibularis
Trods deres relativt lille størrelse producerer GSM > 60% af det samlede mundspyt, og benigne tumorer i GSM behandles konventionelt med eksstirpation af hele kirtlen [18]. I et review fra 2025 indeholdende syv studier og 399 patienter konkluderede man, at partiel resektion i udvalgte tilfælde bl.a. medfører bedre kosmetisk resultat og bevaret spytproduktion, hvilket synes at reducere postoperativ xerostomi og caries [18, 25]. Litteraturen på området er dog ganske sparsom og præget af heterogenitet [25].
Små spytkirtler, glandula sublingualis og intraoral manifestation
Intraorale benigne tumorer, oftest PA, udgående fra små spytkirtler behandles med komplet resektion [14]. Ved tumor i det parafaryngeale rum, som ofte udgår fra den dybe lap af GP [4], kan kombineret transoral og transcervikal adgang være nødvendig [19]. Benigne tumorer i gl. sublingualis er sjældne og behandles med kirurgisk fjernelse af hele spytkirtlen [26].
Komplikationer
Spytkirtelkirurgi er forbundet med en række kirurgiske komplikationer, der er anført i Tabel 3.
Særligt ved det PA er der risiko for tumorrecidiv, og i et studie af Young et al. [5] rapporterede man recidiv hos 1-5% efter 7-10 år. Recidiver tilskrives inkomplet resektion, peroperativ kapselruptur, pseudopodier eller oversete satellitlæsioner [19]. Ved operation for recidiv stiger risikoen yderligere både for fornyet recidiv (46%) [7, 19] og for malign transformation (3,3-24%) [7].
I to tidligere metaanalyser forsøgte man at sammenligne ECD med hhv. SP [22] og PSP [23] uden at finde forskel i tumorrecidiv i forhold til valg af procedure – alle inkluderede studier var dog begrænset af længden på opfølgningen.
I et systematisk review fra 2019 konkluderede man, at adjuverende stråleterapi ved recidiverende PA i GP kan overvejes f.eks. ved multinodal recidiv eller flergangsrecidiv [30].
Alle spytkirteltumorer bør udredes primært med UL og FNA ved øre-næse-hals-læge og skal henvises hertil fra den øvrige primærsektor. De hyppigste benigne spytkirteltumorer er PA og WT, og de fleste tumorer ses i GP. I GSM, GSL og de små spytkirtler skal man være opmærksom på den højere malignitetsrisiko. Den primære behandling er kirurgisk eksstirpation, om end nogle patienter kan tilbydes observation, f.eks. ved asymptomatiske WT’er. PA har en lille risiko for malign transformation over tid. Ved PA er komplet tumorresektion afgørende for at undgå recidiv og malign transformation.
Omfanget af den kirurgiske behandling af benigne tumorer debatteres løbende i litteraturen, særligt for GP. Hvis man kunne implementere en fælles nomenklatur som f.eks. foreslået af ESGS vedrørende tumorer i GP og kirurgisk strategi, ville man på verdensplan kunne sammenholde data og hermed øge evidensen på området.
Korrespondance Tobias Bastian Ross Clemmesen. E-mail: tobiasrossc@gmail.com
Antaget 29. august 2025
Publiceret på ugeskriftet.dk 13. oktober 2025
Interessekonflikter TBRC oplyser ingen interessekonflikter. BIL oplyser ingen interessekonflikter. GBH har siddet i bestyrelsen for Dansk Hoved-Hals Kirurgisk Selskab siden november 2023 ulønnet. Alle forfattere har indsendt ICMJE Form for Disclosure of Potential Conflicts of Interest. Disse er tilgængelige sammen med artiklen på ugeskriftet.dk
Referencer findes i artiklen publiceret på ugeskriftet.dk
Artikelreference Ugeskr Læger 2025;187:V04250352
doi 10.61409/V04250352
Open Access under Creative Commons License CC BY-NC-ND 4.0
Benign tumours of the salivary glands most commonly affect the parotid gland. Diagnostic evaluation should include ultrasound-guided fine needle aspiration, with additional imaging as needed. The most frequent tumour types are pleomorphic adenoma and Warthin’s tumour. This review finds that treatment typically involves surgical excision, although in selected cases, a watchful waiting approach may be appropriate. There is currently no consensus on the optimal surgical technique for all cases. Complete tumour removal, while preserving adjacent nerves and healthy salivary gland tissue, remains essential.