Bivirkninger ved anabole steroider

Josefine Windfeld-Mathiasen1, Thea Christoffersen1 & Henrik Horwitz1, 2
Sammenhængen mellem testikler og mandlig fænotype har været kendt i årtusinder: Kastratsangere bevarede deres lyse stemmer efter pubertetens indtog, og eunukker blev sat til at vogte harem. Også inden for lægevidenskaben har kastration gennem tiden været forsøgt som behandling af en lang række psykiatriske og neurologiske lidelser [1, 2].
Hovedbudskaber
6% af unge mænd har anvendt anabole steroider.
Bivirkningerne er hyppige og anses for at være et folkesundhedsproblem. De hyppigste bivirkninger er hypogonadisme, infertilitet, gynækomasti og akne.
Grundet den brede bivirkningsprofil vil man i mange specialer møde misbrugere af anabole steroider.
I 1849 udførte den tyske læge og fysiolog Arnold Adolph Berthold et centralt eksperiment for endokrinologien, da han demonstrerede, at det var muligt at transplantere testikler til kastrerede hanekyllinger, hvorefter de udviklede den klassiske fænotype for haner [3]. En ny hypotese var således dannet: Testikler secernerede en viriliserende substans, der blev distribueret rundt i organismen via blodbanen [2, 3].
I 1889 rapporterede lægen og videnskabsmanden Charles Edouard Brown-Sequard i en artikel i The Lancet om de positive effekter, han havde oplevet på sit aldersmæssige forfald ved at injicere sig med ekstrakt fra dyretestikler [4]. Brown-Sequards opdagelser, eller måske snarere iagttagelser, opnåede hurtigt kommerciel interesse, og produkter som Sequarine og Elixir Brown-Sequard så dagens lys [5]. Samme år anvendte baseballspilleren Pud Galvin i en kamp mellem Boston og Pittsburgh et af disse produkter med ganske overbevisende effekt [6]. Retrospektivt tyder alt dog på, at Pud Galvins og Brown-Sequards oplevelser primært kan tilskrives placebo, idet mængden af testosteron, som kan udvindes fra dyretestikler, er langt fra det terapeutiske niveau [7].
I 1935 lykkedes det så endelig at isolere og syntetisere testosteron, som hurtigt fandt vej ind i sportens verden [8]. Særligt brugen af anabole steroider i det tidligere DDR er veldokumenteret, og nationen var, i forhold til sin størrelse, førende inden for styrkesportsgrene som vægtløft og kuglestød [9]. Foruden det historiske belæg for testosterons effekt på muskelmasse og performance er effekten veldokumenteret i kliniske undersøgelser [10, 11].
I dag ved vi, at naturligt forekommende testosteron primært syntetiseres i testiklernes Leydigceller som respons på lutropin (LH)-sekretion fra hypofysen, og at den daglige produktion af testosteron ligger på 5-7 mg. Testosteron omdannes primært til inaktive stoffer i leveren, dog omdannes omkring 5% til det mere potente dihydrotestosteron (DHT) af enzymet 5-alfareduktase, som findes i forskellige væv. En lille del af testosteronet omdannes til østradiol af enzymet aromatase. Testosteron og DHT binder sig til den intracellulære androgenreceptor, hvilket fører til transkription af gener, som i sidste ende resulterer i karakteristika for det mandlige køn [11]. Bhasin et al viste i et randomiseret, placebokontrolleret studie, at 600 mg testosteron ugentligt i ti uger uden træning ledte til ca. 3 kg forøgelse af kroppens fedtfri masse og 10 kg forbedring ved bænkpres [10].
Desværre er brug af syntetiseret testosteron, androgene anabole steroider (AAS), ikke kun en hurtig vej til muskelstyrke og et attraktivt ydre, men også forbundet med en lang række af alvorlige helbredskonsekvenser. Dette er særligt alvorligt, da anabole steroider er vidt udbredt i samfundet og estimeret til have en livstidsprævalens blandt mænd på helt op til 6% [12]. I denne artikel vil vi kort gennemgå bivirkningerne ved brug af AAS.
For AAS er listen af formodede negative helbredseffekter lang, og brugerne er generelt overrepræsenterede i det danske sundhedsvæsen. I denne artikel vil vi dog kun berøre de stærkeste bivirkningssignaler [12].
Hypogonadisme
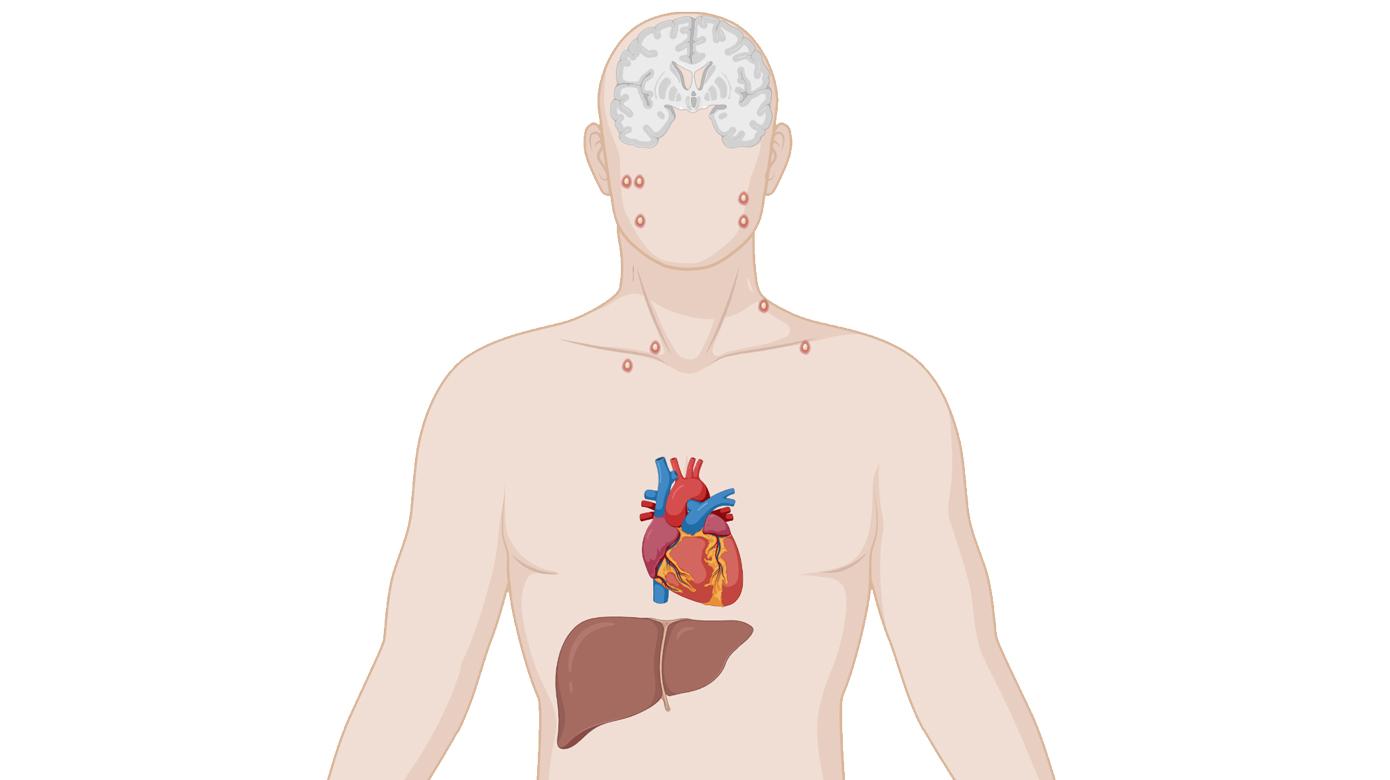
Det er velkendt, at AAS påvirker testiklernes funktion via suppression af kroppens naturlige hypothalamus-hypofyse-gonade-akse [13-15] (Figur 1). De store mængder af eksogene androgener leder til nedsat sekretion af LH/follikelstimulerende hormon (FSH), og som konsekvens heraf udvikles der hypogonadisme med heraf følgende lav endogen testosteronproduktion og reduceret spermatogenese [14, 16].
Testosteronmangel
I perioder med AAS-abstinens vil brugerne være i androgenmangel. Dette afstedkommer både nogle psykiske og fysiske symptomer. De psykiske symptomer gennemgås i separat afsnit.
Rasmussen et al fandt, at tidligere brugere af AAS havde signifikant lavere testosteronniveauer end raske kontrolpersoner [14], mens Shankara-Narayana et al fandt et gennemsnitligt lavere niveau af testosteron om end ej statistisk signifikant [16].
Symptomerne på lave testosteronniveauer omfatter nedsat libido, depression og erektil dysfunktion og er yderst prævalent blandt tidligere brugere [11, 14]. I overensstemmelse med dette fandt man i et dansk kohortestudie af 545 mænd, som blev dopingsanktioneret for brug af AAS i perioden 2006-2018, at lidt under 2% havde fået testosteron på recept, og endelig havde 11% indløst recept for lægemidler mod erektil dysfunktion, dette var henholdsvis otte og tre gange så høj prævalens som i baggrundsbefolkningen [17]. Langtidskonsekvenserne af androgenmangel efter AAS-misbrug er dårligere belyst, men man kan foruden ovennævnte i yderste konsekvens forestille sig kliniske problemstillinger med knogletætheden [1].
Fertilitet
Fertiliteten blandt brugere af AAS har indtil for nylig været uoplyst terræn. I kliniske studier har man undersøgt effekten af testosteron som mandligt kontraceptivum og fundet, at fertiliteten genvindes 3-12 måneder efter endt behandling [18]. Eksponeringen ved motionsdoping er dog væsentligt højere.
Rasmussen et al undersøgte fertilitetsmarkører blandt tidligere og nuværende brugere af AAS [14]. De fandt, at LH, FSH, antimüllersk hormon og inhibin B-niveauet normaliseredes efter endt brug. Lignende observationer blev senere gjort af to forskellige forskningsgrupper i hhv. Australien og Holland, men de målte også på semen og fandt ligeledes, at sædcellekoncentrationen returnerede til normalområdet ved abstinens fra AAS [16, 19].
I ovennævnte danske kohortestudie fandt man, at 6,6% var diagnosticeret med infertilitet, hvilket var dobbelt så mange som i den alders- og kønsmatchede kohorte [17]. Yderligere opfølgning har vist, at AAS-misbrugerne havde halv så høj fertilitetsrate som de matchede kontrolpersoner i årene omkring dopingsanktionen, men efterfølgende lå fertiliteten på niveau med baggrundspopulationens. Interessant nok var brugen af kunstig befrugtning heller ikke større blandt AAS-misbrugere end i baggrundsbefolkningen, hvilket indikerer, at påvirkningen af spermatogenesen er reversibel [15].
Gynækomasti
En ganske frygtet og velkendt bivirkning blandt steroidmisbrugere er gynækomasti. Dette opstår pga. suprafysiologiske niveauer af østrogen i forbindelse med metabolisme af AAS, der således forskyder østrogen-testosteron-ratioen [11, 17]. Yderligere misbruges der ofte andre hormoner samtidig med AAS, f.eks. humant choriongonadotropin, væksthormon og binyrebarkhormon, som også kan lede til udvikling af gynækomasti [20]. Ved brystudvikling er der blandt AAS-misbrugere en tendens til at lægge et ekstra lægemiddel oveni: en østrogenrecepterantagonist som eksempelvis tamoxifen [13], og blandt danske AAS-misbrugere er en ud af syv blevet behandlet for gynækomasti i sundhedsvæsenet, og omtrent halvdelen af disse har undergået operation [17].
Akne
En anden testosteroninduceret og forventelig bivirkning ved steroidmisbrug er akneudvikling [13]. I ovennævnte danske kohortestudie havde en fjerdedel af AAS-misbrugerne indløst recept på lægemidler til behandling af akne, hvilket var 10% flere end forventet sammenlignet med matchede kontrolpersoner. Herudover var incidensen af hospitalskontakter på baggrund af kutane abscesser og karbunkler overraskende høj [17].
Kardiovaskulære forhold
Misbrug af AAS er stærkt mistænkt for at øge risikoen for kardiovaskulær sygdom, og incidensen af noniskæmisk hjertesygdom såsom kardiomyopati og atrieflimren er ca. tre fold forøget hos AAS-misbrugere. [17]
En række markører for kardiovaskulær sygdom er desuden sat i forbindelse med AAS-misbrug, såsom forhøjet systolisk døgnblodtryk og stivhed af aorta [21], ændringer i kolesterolomsætningen med reduceret niveau af HDL og øget niveau af LDL [13] samt påvirkning af koagulationssystemet i en trombofil retning via bl.a. reduceret fibrinolyse og øget trombindannelse [22, 23]. Dette afspejles også tydeligt i, at incidensen for tromboemboliske sygdomme (tromboflebitis og lungeemboli) er fem gange højere hos AAS-misbrugere end i baggrundsbefolkningen [17].
Lever
Ved indtag af AAS står leveren for langt størstedelen af testosteronmetabolismen. Leverpåvirkning ved AAS i både terapeutisk og misbrugsøjemed er omdiskuteret, men der ses en tendens til levertoksicitet. Særligt oralt administreret AAS tyder på at påvirke leveren [11, 13].
Andre somatiske symptomer
Det tidligere omtalte danske registerstudie har vist, at AAS-brugere generelt er overrepræsenterede i sundhedsvæsenet. Af yderligere diagnoser, som forekommer med en statistisk signifikant overhyppighed, kan nævnes rygsmerter, skulderlæsioner og hernier [17]. Om disse symptomer kan tilskrives AAS eller blot excessiv vægttræning er uklart.
AAS synes at påvirke det mentale helbred. Både aggression, depression og mani er velbeskrevne bivirkninger [14, 24]. Mekanismen bag dette er ikke fuldt ud afklaret, men beror formodentlig på både periodevise suprafysiologiske niveauer af steroidhormon og lave testosteronniveauer i perioder med abstinens (på baggrund af endogen suppression af testosteronproduktionen). Kliniske studier har vist, at testosteronsupplement har antidepressive egenskaber hos mænd. Endvidere er det kendt, at androgen suppressionsbehandling ved prostatacancer er associeret med depression [25-27].
Indtag af AAS ledsages formentlig af en særlig form for risikoadfærd, der understreges ved, at mænd, der misbruger anabole steroider, har en ni gange højere risiko for at få en fængselsdom, end baggrundsbefolkningen har. Denne sammenhæng er korrigeret for socioøkonomiske og psykiatriske faktorer [28].
Givet ovenstående bivirkningsprofil samt den socioøkonomiske slagside er det ikke overraskende, at man i en række studier finder en øget mortalitet blandt misbrugere af AAS. I en dansk kontekst er dødeligheden ca. tre gange højere end i baggrundsbefolkningen [12]. Årsagerne til præmatur død tilskrives ofte selvmord og akut myokardieinfarkt [17, 29].
Vi har ovenfor gennemgået de stærkeste bivirkningssignaler for AAS. Vores konklusioner er primært baseret på et dansk kohortestudie med 545 dopingsanktionerede mænd, som i gennemsnit er fulgt i syv år efter dopingsanktionen gennem Landspatientregistret med en hypotesefri tilgang. Det studie har vist, at de primære problemstillinger ved AAS-misbrug er relateret til hypogonadisme, gynækomasti og akne, altså klassiske type A-bivirkninger [12].
Selv for konventionelle lægemidler er det vanskeligt at undersøge langtidsbivirkninger [30], men for misbrugsstoffer er det endnu mere komplekst, da data er relativt begrænsede, forhold omkring eksponering og øvrigt misbrug generelt er ukendt, og analyserne sløres af misbrugernes generelle risikoadfærd.
Hertil kommer, at gruppen AAS dækker over en lang række kemiske substanser med testosteronlignende struktur og egenskaber. Visse af disse substanser er primært udviklet til veterinært brug [17]. Det er derfor vanskeligt at vurdere, hvilke bivirkninger AAS-misbrug har på 20- eller 30-årigt sigt, ligesom sjældne bivirkninger vil gå under radaren.
Grundet den vide udbredelse af AAS-misbrug og de mange forskelligartede symptomer herpå vil klinikere inden for en lang række af specialer komme i kontakt med denne patientpopulation, og det er derfor vigtigt at have en generel viden om bivirkningerne ved disse stoffer. Om end misbrug af AAS jf. litteraturen er forbundet med en vis social slagside, er det værd at bemærke, at majoriteten af misbrugerne generelt er i arbejde og formentlig velfungerende [28]. Med dette in mente illustrerer Figur1 de hyppigste red flags for AAS-misbrug.
Vi har i nærværende artikel haft fokus på de symptomer, som ses ved mandlige misbrugere, da udbredelsen af AAS-misbrug blandt kvinder er væsentligt lavere [17]. De symptomer, som typisk er rapporteret blandt kvindelige AAS-misbrugere, angår primært virilisering og omfatter bl.a. hirsutisme, klitorishypertrofi, dyb stemme og amenorré [9].
AAS-misbrug er forbundet med en lang række bivirkninger, blandt de hyppigste er hypogonadisme, infertilitet, gynækomasti og akne. Hertil kommer et bredt spektrum af psykiske bivirkninger samt kriminalitetsassocieret adfærd.
Korrespondance Henrik Horwitz. E-mail: henrik.horwitz@regionh.dk
Antaget 27. september 2022
Publiceret på ugeskriftet.dk 14. november 2022
Interessekonflikter Der er anført potentielle interessekonflikter. Forfatternes ICMJE-formularer er tilgængelige sammen med artiklen på ugeskriftet.dk
Artikelreference Ugeskr Læger 2022;184:V06220373
Josefine Windfeld-Mathiasen, Thea Christoffersen & Henrik Horwitz
Ugeskr Læger 2022;184:V06220373
Anabolic steroid abuse is a growing health concern due to its relatively prevalent use and adverse health effects. These drugs cause significant disturbances of the body’s endocrine system, and the most common somatic adverse drug reactions are gynaecomastia, infertility, testicular dysfunction, and acne. Furthermore, the use of anabolic steroids is associated with a variety of psychiatric disorders and antisocial behaviour as summarised in this review.
Wilson JD, Roehrborn C. Long-term consequences of castration in men: lessons from the Skoptzy and the Eunuchs of the Chinese and Ottoman Courts. J Clin Endocrinol Metab. 1999;84(12):4324-31.
Nieschlag E, Nieschlag S. Endocrine history: the history of discovery, synthesis and development of testosterone for clinical use. Eur J Endocrinol. 2019;180(6):R201–R212.
Berthold AA. Transplantation der Hoden. Archiv für Anat., Physiol. und wiss. Med. 1849:42-46.
Brown-Séquard CE. Note on the effects produced on man by subcutaneous injections of a liquid obtained from the testicles of animals. Lancet. 1889;134(3438):105-107.
Borell M. Brown-Séquard’s organotherapy and its appearance in america at the end of the nineteenth century. Bull Hist Med. 1976;50(3):309-320.
Deitch C. This week in Pittsburgh Sports History. Pittsburgh City Paper. https://www.pghcitypaper.com/pittsburgh/this-week-in-pittsburgh-sports-history/Content?oid=3742022 (1. aug 2022).
Cussons AJ, Walsh JP, Bhagat CI, Fletcher SJ. Brown‐Séquard revisited: a lesson from history on the placebo effect of androgen treatment. Med J Aust. 2002;177(11-12):678-9.
Hoberman JM, Yesalis CE. The history of synthetic testosterone. Sci Am. 1995;272(2):76-81.
Franke WW, Berendonk B. Hormonal doping and androgenization of athletes: a secret program of the German Democratic Republic government. Clin Chem. 1997;43(7):1262-79.
Bhasin S, Storer TW, Berman N et al. The effects of supraphysiologic doses of testosterone on muscle size and strength in normal men. N Engl J Med. 1996;335(1):1-7.
Horwitz H, Christoffersen T. A review on the health hazards of anabolic steroids. Adverse Drug React Bull. 2019;317(1):1227-1230.
Sagoe D, Molde H, Andreassen CS et al. The global epidemiology of anabolic-androgenic steroid use: a meta-analysis and meta-regression analysis. Ann Epidemiol. 2014;24(5):383-98.
Hartgens F, Kuipers H. Effects of androgenic-anabolic steroids in athletes. Sports Med Auckl NZ. 2004;34(8):513-54.
Rasmussen JJ, Selmer C, Østergren PB et al. Former abusers of anabolic androgenic steroids exhibit decreased testosterone levels and hypogonadal symptoms years after cessation: a case-control study. PLoS One. 2016;11(8):e0161208.
Windfeld-Mathiasen J, Dalhoff KP, Andersen JT et al. Male fertility before and after androgen abuse. J Clin Endocrinol Metab. 2021;106(2):442–9.
Shankara-Narayana N, Yu C, Savkovic S et al. Rate and extent of recovery from reproductive and cardiac dysfunction due to androgen abuse in men. J Clin Endocrinol Metab. 2020;105(6):dgz324.
Horwitz H, Andersen JT, Dalhoff KP. Health consequences of androgenic anabolic steroid use. J Intern Med. 2019;285(3):333-40.
Liu PY, Swerdloff RS, Christenson PD et al, Hormonal Male Contraception Summit Group. Rate, extent, and modifiers of spermatogenic recovery after hormonal male contraception: an integrated analysis. Lancet. 2006;367(9520):1412-20.
Smit DL, Buijs MM, de Hon O et al. Disruption and recovery of testicular function during and after androgen abuse: the HAARLEM study. Hum Reprod Oxf Engl. 2021;36(4):880-890.
Kanakis GA, Nordkap L, Bang AK et al. EAA clinical practice guidelines – gynecomastia evaluation and management. Andrology. 2019;7(6):778-793.
Rasmussen JJ, Schou M, Madsen PL et al Increased blood pressure and aortic stiffness among abusers of anabolic androgenic steroids: potential effect of suppressed natriuretic peptides in plasma? J Hypertens. 2018;36(2):277-285.
Sidelmann JJ, Gram JB, Rasmussen JJ, Kistorp C. Anabolic-androgenic steroid abuse impairs fibrin clot lysis. Semin Thromb Hemost. 2021;47(1):11-17.
Chang S, Rasmussen JJ, Frandsen MN et al Procoagulant state in current and former anabolic androgenic steroid abusers. Thromb Haemost. 2018;118(4):647-653.
Pope HG, Wood RI, Rogol A et al. Adverse health consequences of performance-enhancing drugs: an Endocrine Society scientific statement. Endocr Rev. 2014;35(3):341-375.
Walther A, Breidenstein J, Miller R. Association of testosterone treatment with alleviation of depressive symptoms in men: a systematic review and meta-analysis. JAMA Psychiatry. 2019;76(1):31-40.
Oberlander JG, Henderson LP. The Sturm und Drang of anabolic steroid use: angst, anxiety, and aggression. Trends Neurosci. 2012;35(6):382-392.
Fischer S, Ehlert U, Amiel Castro R. Hormones of the hypothalamic-pituitary-gonadal (HPG) axis in male depressive disorders - a systematic review and meta-analysis. Front Neuroendocrinol. 2019;55:100792.
Christoffersen T, Andersen JT, Dalhoff KP, Horwitz H. Anabolic-androgenic steroids and the risk of imprisonment. Drug Alcohol Depend. 2019;203:92-97.
Pärssinen M, Kujala U, Vartiainen E et al. Increased premature mortality of competitive powerlifters suspected to have used anabolic agents. Int J Sports Med. 2000;21(3):225-227.
Strand NAW, Vinther S, Horwitz H. Information og misinformation om bivirkninger. Ugeskr Laeger. 2021;183:V09200645.