Cervikal spondylotisk myelopati

David A.L.W. Cant1, Simon Bøtker Kongsvad Andersen2 & Kristian Høy1, 3
Cervikal spondylotisk myelopati (CSM) er hyppigste form for rygmarvslidelse hos voksne > 55 år.
Der er en diagnostisk forsinkelse på 2,2-6,3 år.
CSM er kendetegnet ved progressivt gangbesvær, nedsat fingerfærdighed samt spasticitet i underekstremiteten. Gangbesværet øger risikoen for faldtraumer, som kan medføre alvorlig forværring af CSM.
Cervikal spondylotisk myelopati (CSM) er en hyppigt forekommende progressiv tilstand, der er kendetegnet ved aldersrelaterede degenerative forandringer i columna cervicalis, hvilket resulterer i gradvist ophævet liquorflow og efterfølgende kompression af rygmarven og/eller de omgivende blodkar [1, 2]. Kompressionen opstår med baggrund i den spondylotiske ryg med degenerative forandringer omkring diskus, vertebra, facetled og ligamenter medførende nedsat plads i spinalkanalen (Figur 1) [2, 3].
Trods CSM er den hyppigste form for rygmarvslidelse hos voksne > 55 år, er diagnosen forbundet med en betydelig diagnostisk forsinkelse på 2,2 til 6,3 år, hvilket medfører øget risiko for udvikling af irreversibel nerveskade og potentiel invaliditet [1-4].
Incidensraten for CSM-relaterede hospitaliseringer er estimeret til omkring 4 pr. 100.000 personår og 1,6 pr. 100.000 personår for operativt behandlede patienter [5-7]. Med den voksende andel af ældre i befolkningen forventes incidensen at stige. Den egentlige incidens og prævalens er fortsat ikke tilstrækkeligt præciseret i litteraturen [6]. Det er estimeret, at omkring 10% af voksne > 55 år har kliniske symptomer på CSM. Hertil at 31,6% af populationen > 50 år og 66,8% af > 80-årige har MR-verificeret kompression af rygmarven med risiko for symptomudvikling [8-10]. Gennemsnitsalderen for opererede patienter er på 57 ± 12 år [11].
I udlandet har man fundet, at 69% af patienterne initialt udredes i almen praksis, 21% på ortopædkirurgisk afdeling og de resterende 10% fordelt blandt neurokirurgiske, neurologiske eller andre samarbejdspartnere [4]. Grundet en betydelig diagnostisk forsinkelse, en forventet stigning i forekomst af CSM samt konsekvensernes alvor ved forsinket diagnostik finder vi en øget bevågenhed af sygdommen nødvendig for at fremme tidlig opsporing og udredning mhp. at forhindre varig invaliditet og nedsat helbredsrelateret livskvalitet.
Selvom patofysiologien ikke er fuldt klarlagt, menes den at være multifaktoriel og kan groft inddeles i statisk og dynamisk kompression. Statisk kompression inkluderer medfødte og erhvervede tilstande såsom kongenit spinalstenose, diskusherniering, osteofytdannelse, indfoldning af ligamentum flavum og facetledskapsel samt ligamentøs hypertrofi (Figur 2) [2, 12-15]. Konsensus er, at den statiske kompression af rygmarven og dertilhørende reducerede blodtilførsel kan forårsage lokal intraparenkymal iskæmi, som frembringer et neuroinflammatorisk respons af mikroglia og makrofager, hvilket bevirker til neural degeneration. I sene stadier forekommer endotelcelledysfunktion i blod-rygmarvs-barrieren, hvilket yderligere aktiverer immuncelleinfiltration. Derved kan kompression bl.a. forårsage neuronal og oligodendroglial apoptose, neural demyelinisering, astrogliose og aksonal degeneration [5, 12].
Dynamisk kompression beror typisk på repetitive traumer og nakkebevægelser ud over normal range of motion. Dette kan resultere i acceleration af den degenerative udvikling og dermed yderligere udvikling af spondylose [2, 13].
Patienter med CSM er i høj risiko for at udvikle svære neurologiske symptomer som kvadriplegi og central cord syndrome, selv efter mindre traumer uden frakturer eller dislokationer [3, 5, 10, 14]. Dette skyldes fortrængning af cerebrospinalvæsken og den deraf manglende stødabsorption omkring rygmarven, hvorved den komprimeres direkte [5].
På baggrund af varierende grad af kompression af rygmarven og nerverødderne kan patienter med CSM fremstå med et bredt spænd af symptomer og kliniske fund (Tabel 1) [17].
CSM bør undersøges hos ældre – med en overvægt af mænd – der har gangbesvær samt tab af finmotorik i overekstremiteten. Gangen kan være præget af spasticitet og styringsbesvær, og i ekstremiteterne kan der være ledsagende sensorisk dysfunktion i form af paræstesi og ændret proprioception (Tabel 1 og Figur 3) [2, 4, 14-19].
Grundet risiko for involvering af både rygmarv og nerverødder vil patienter ofte have motoriske deficit af både første og anden motorneuron-skader, som både kan fremtræde symmetrisk og asymmetrisk [2, 14].
Overekstremiteten rammes ofte af anden motorneuron-deficit, som ses ved rodkompression og inkluderer symptomer som kraftnedsættelse, muskelatrofi, fascikulationer, hyporefleksi og hypotoni (Tabel 1). Dette betyder bl.a., at patienten ofte oplever tab af finmotorik og heraf følgende besvær ved at knappe sin skjorte, spise med ske samt at skrive i hånden [1, 2, 14, 15]. Hvis rygmarvskompressionen i stedet forekommer i den proksimale del af cervikalkanalen, vil der typisk ses øvre motorneuron-deficit. Hos den klassiske myelopatihånd findes positiv »finger-escape-sign«, som viser sig ved, at ved ekstension og adduktion af fingrene abduceres femte finger spontant grundet nedsat kraft i den intrinsiske muskulatur, og »grip and release test«, der ved knyttet hånd og derefter ekstension af fingrene fremviser forsinket og langsom ekstension, kombineret med atrofi af den intrinsiske håndmuskulatur (Tabel 1) [20].
I underekstremiteten erkendes altovervejende kun første motorneuron-skade, da symptomerne forekommer grundet involvering af tractus corticospinales. Dette symptombillede er karakteriseret ved bl.a. muskelsvaghed, hyperrefleksi og hypertoni (også kaldet »long-tract signs«) (Tabel 1). Usikker gang og balanceproblemer er det hyppigst forekommende symptom og derved et kendetegn for CSM. Gangen er typisk spastisk, bredsporet, langsom og tøvende [1, 2, 14-16].
Til graduering af CSM benyttes ofte Nüricks skala og modificeret Japanese Orhopedic Associations skala (mJOA) [16]. Sidstnævnte er den mest anvendte og gradueres i fire underklasser baseret på den motoriske og sensoriske funktion i over- og underekstremiteten, trunkal sensorik og blæredysfunktion [17].
Der findes forskellige tilstande, der minder om CSM, hvilket ofte skyldes den langsomme progression af symptomer samt et mangeartet symptombillede. De hyppigst forvekslede tilstande indbefatter bl.a. amyotrofisk lateralsklerose (ALS), multipel sklerose (MS) og B12-mangel [1, 14, 15, 19]. Denne artikel vil ikke give en fyldestgørende redegørelse for, hvordan CSM kan skelnes fra differentialdiagnoserne. Trods sammenlignelighed med ALS og MS kan klinikeren med øje for patientens alder, køn, forekomst af første og anden motorneuron-skade, sensorisk dysfunktion samt kranienerveinvolvering bruge den kliniske præsentation til at tale for eller imod CSM. Andre forvekslede tilstande nævnt i litteraturen er bl.a. Parkinsons sygdom, syringomyeli, spinale neoplasier, perifer neuropati, karpaltunnelsyndrom, cervikal diskusprolaps med radikulopati og normaltrykshydrocefalus [4, 15, 19, 21].
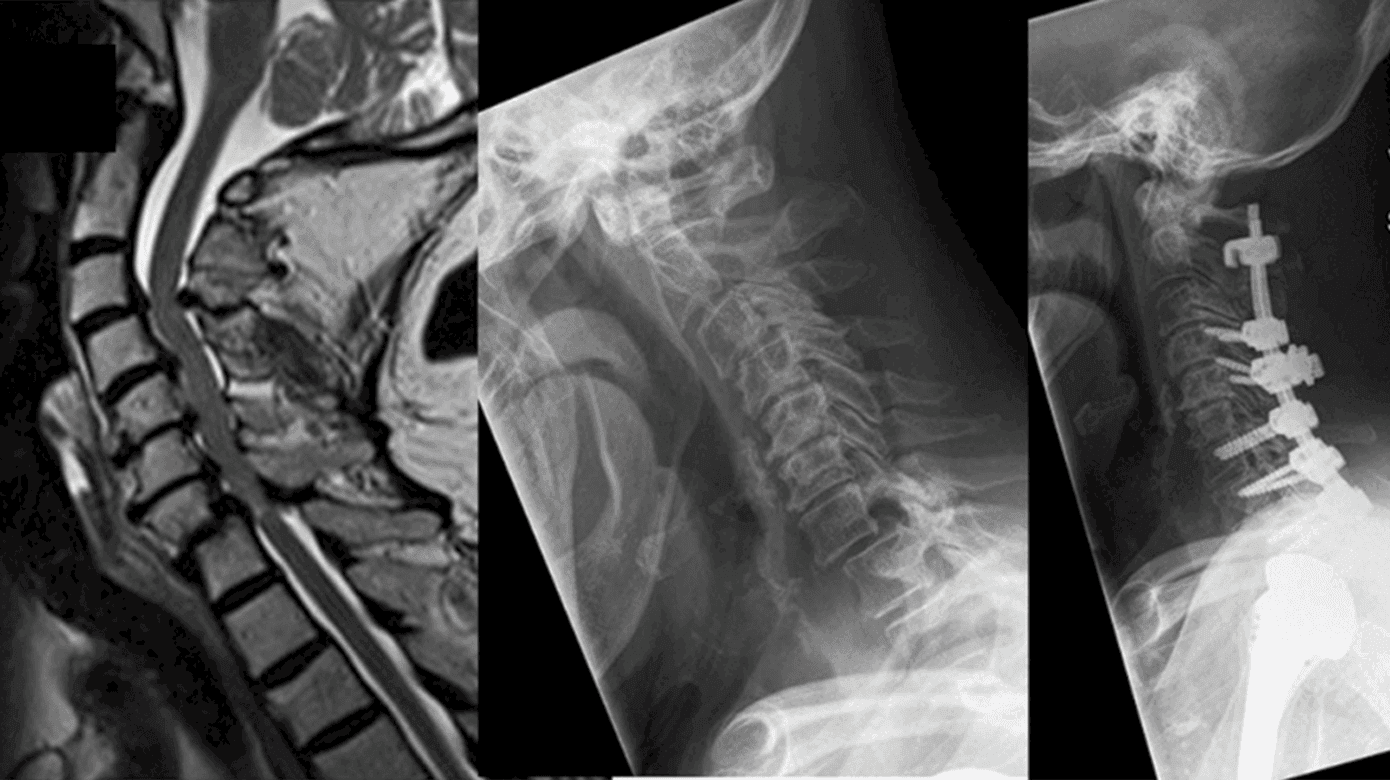
MR-skanning af columna cervicalis er den foretrukne billedmodalitet og et uundværligt redskab i udredningen af CSM (Figur 3). Ved konventionel MR (T1/T2/STIR-vægtet) kan klinikeren verificere graden af degeneration (spondylose, ossifikation af posterior longitudinale ligament, diskusprolaps, hypertrofi af lig. flavum, osteofytdannelse), rygmarvskompression, ændringer i spinalkanalens diameter og ændringer i signalintensiteten (Figur 1) [2, 22, 23]. Bl.a. kan signalændringer i rygmarven have en prognostisk betydning for patienten. På T2-vægtet optagelse vil en lav signalintensitet uden skarp afgrænsning generelt repræsentere potentielt reversibel myelopati. Derimod vil høj signalintensitet på T2- og lav signalintensitet på T1-vægtede billeder ofte repræsentere irreversibel myelopati såsom kavitation, neuralt vævstab, myelomalaci, nekrose og spongiforme ændringer i den grå substans [14, 18, 22, 23]. Herudover er MR nødvendig for at udelukke differentialdiagnoser til CSM såsom tumor, syringomyeli, demyeliniserede plaques mv. (Figur 3). Det er vigtigt at understrege, at MR-skanningens fund ikke kan stå alene, da det ikke er ualmindeligt, at asymptomatiske patienter har billeddiagnostiske tegn på CSM [9, 23, 24].
Ved behov for yderligere udredning eller præoperativ planlægning kan en CT være værdifuld. Her ses bedre visualisering af knogleanatomien, foramener, vertebralarteriernes forløb samt de degenerative knogleforandringer og forkalkninger sammenlignet med MR [2, 23]. Ved røntgen af columna cervicalis kan måleværktøjer som Torg-Pavlov-ratio samt compression ratio understøtte mistanken om en snæver spinalkanal [1, 2]. Røntgen har dog ingen plads i udredningen.
Trods betragtninger omhandlende de samfundsøkonomiske omkostninger ved MR-skanninger understreges det, at CSM er en alvorlig tilstand, som kræver den nødvendige udredning i form af MR-skanning, da ubehandlet CSM kan føre til invaliditet og irreversible skader.
Behandlingen af CSM kan opdeles i konservativ og operativ behandling. Den konservative behandling består primært af immobilisering, ergonomiske tiltag, livsstilsmodifikationer, smertebehandling samt at forhindre traumer med risiko for pludselig forværring [1, 2].
Den kirurgiske behandling bygger på en pladsgivende operation med dekompression af nerverne samt evt. korrektion af sagittal alignment [25]. Der findes tre operative muligheder: en anterior, posterior og kombineret adgang. Litteraturen har trods adskillelige forsøg ikke kunnet påvise en entydig/overbevisende overlegenhed ved den ene tilgang sammenlignet med den anden. Valget beror i stedet primært på tilstedeværelsen af cervikal kyfose/lordose, anatomisk placering af stenosen, antal afficerede segmenter samt operatørens præference [15, 26, 27]. De operative indgreb kan med eller uden instrumenteret fusion indbefatte korpektomi, laminektomi, diskektomi, laminoplastik samt fusion ved tab af sagittal alignment [26].
Grundet CSM’s progressive natur er behandlingen af CSM altovervejende kirurgisk. Det har været meget omdiskuteret, hvorvidt konservativ tilgang har nogen plads i behandlingen af CSM, og i særdeleshed hvilke patienter der i så fald bør tilbydes dette.
Konsensus er, at nonoperativ behandling er forbeholdt hos patienter med mild CSM (mJOA 15-17). Frembyder patienten forværring eller manglende bedring, bør operativ behandling tilbydes. Patienter med moderat (mJOA 12-14) eller svær CSM (mJOA 0-11) bør generelt behandles operativt, hvor behandlingen er forbundet med bedring i funktionalitet og neurologiske symptomer, reducerede smerter samt øget generel patienttilfredshed [28-30]. I et internationalt systematisk review fandt man både efter 12 og 24 måneder en signifikant bedring i bl.a. livskvalitet, bevægelighed af nakken samt en stigning i mJOA fra 12,5 til 14,9. Hertil var den neurologiske komplikationsrate kun 3,13% [8]. Evidensen er tydelig, hvad angår konservativt behandlede patienter med moderat til svær CSM, som er forbundet med forværring af neurologiske symptomer samt almindelig daglig livsførelse (ADL) [10, 23, 28, 30]. Prognosen for konservativt behandlede patienter afhænger bl.a. af symptomgraden (mJOA), alder og antallet af involverede segmenter. Det er estimeret, at 26-50% forværres neurologisk, og næsten ingen oplever spontan bedring. 75% forværres trinvist, 20% forværres langsomt, og 5% oplever en hurtig debut af symptomer [4, 10, 15]. Da sygdommen er progressiv i sin natur, anbefales det at operere inden for tre måneder, hvis patienten har myelotiske forandringer i rygmarven. Dette er dels grundet progression af symptomer og deraf udvikling af irreversibel myelopati, dels at progression af symptomer øger risikoen for faldtraumer med risiko for alvorlig forværring af både erkendt og uerkendt medullopati.
CSM er den hyppigste rygmarvslidelse hos voksne. Med en betydelig diagnostisk forsinkelse er øget bevågenhed en nødvendighed for at forhindre irreversibel myelopati, invaliditet og livslang nedsat ADL. Karakteristiske symptomer indbefatter ganginstabilitet og nedsat finmotorik i hænderne. Udredning indbefatter klinisk undersøgelse samt billeddiagnostik i form af MR-skanning. Behandlingen er altovervejende kirurgisk.
Korrespondance David A.L.W. Cant. E-mail: davcan@rm.dk
Antaget 28. juni 2024
Publiceret på ugeskriftet.dk 2. september 2024
Interessekonflikter Der er anført potentielle interessekonflikter. Forfatternes ICMJE-formularer er tilgængelige sammen med artiklen på ugeskriftet.dk
Referencer findes i artiklen publiceret på ugeskriftet.dk
Artikelreference Ugeskr Læger 2024;186:V02240149
doi 10.61409/ V02240149
Open Access under Creative Commons License CC BY-NC-ND 4.0
Cervical spondylotic myelopathy (CSM) is a progressive degenerative condition of the cervical spine and the most common cause of spinal cord injury in adults >55 years of age. Degenerative changes in the spine lead to spinal cord compression, resulting in symptoms such as gait instability, loss of dexterity in the hands, weakness, and sensory deficits. Diagnosis is delayed by 2,2–6,3 years and includes clinical examination and imaging such as MRI. Management of CSM is primarily surgical treatment. This review highligths the importance of early recognition and appropriate treatment in optimising patient outcomes.