Den raske og den syge hjernes bevidsthedsfunktion

Daniel Kondziella
Strategiske læsioner i hjernestammen, ekstensive bihemisfæriske skader og global metabolisk dysfunktion påvirker hjernens bevidsthedsfunktion. Patienter kan med eller uden kognitive skader vågne fra koma ved successivt at passere igennem faser med begrænset til fuld bevidsthed. Der findes dog også patienter, der er ved fuld bevidsthed, men ikke er i stand til at vise det, fordi de har mistet enhver form for motorfunktion – en tilstand af kognitiv-motorisk dissociation, som først er blevet dokumenteret i 2006 [1]. Funktionel billeddannelse af hjernen, avancerede elektroencefalografi (EEG)-paradigmer og forfinede kliniske undersøgelsesteknikker har banet vejen for en mere nuanceret forståelse af de mange facetter af tilstande, der er associeret med nedsat bevidsthedsfunktion, og neurologer tænker i stigende grad i termer som neuronale netværk i modsætning til isolerede hjernelæsioner [2]. I denne artikel gives der et overblik over aktuelle hypoteser om bevidsthedsfunktionen i den raske hjerne og de patofysiologiske mekanismer, som fører til bevidsthedstab, med vægt på de specifikke kliniske tegn og syndromer, hvis erkendelse er afgørende for korrekt klassificering af en given patients bevidsthedsgrad.
Der er gjort utallige forsøg på at definere den menneskelige bevidsthed: Filosoffer, teologer, litterater, psykologer og jurister har hver især deres definitioner, som er kommet og gået i tidernes løb. For lægevidenskabens vedkommende har William James (1894) formuleret en brugbar fortolkning: »Den normale menneskelige bevidsthed består af en seriel, tidsafhængig, organiseret, begrænset og reflekterende erfaring af en selv og omverdenen« [3]. Derudover eksisterer den normale bevidsthedsfunktion på to akser, nemlig vågenhedsgrad og bevidsthedsindhold. Den menneskelige bevidsthed er associeret med qualia, som betegner det faktum, at vi ved, »hvordan det føles« at være ved bevidsthed. De vigtigste qualia er vores autobiografiske identitet (»jeg er den, jeg er«), fornemmelsen af at vores handlinger udgår fra os selv (»jeg gør, fordi jeg beslutter mig til det«), og fornemmelsen af at vores krop og dens funktioner tilhører os. Vi har en god biologisk forståelse af, hvordan vågenhed opstår; nemlig via aktiverende neuronale baner, der stammer fra den øvre pons og mesencefalon, herunder det rostrale dorsolaterale pontine tegmentum [4], med ekstensive projektioner til cortex via relæstationer i thalamus, hypothalamus og visse subkortikale strukturer, som bedst opsummeres under den engelske betegnelse basal forebrain. Adskillige neurotransmitterstoffer indgår i denne proces, deriblandt acetylkolin, noradrenalin, dopamin, serotonin, histamin og hypokretin. Hvordan bevidsthed som sådan
opstår, dvs. hvad det er, som producerer vores bevidsthedsindhold, hører derimod til blandt de store eksistentielle spørgsmål, som vi mangler et konkret svar på, på lige fod med spørgsmålet om universets oprindelse. Det er stadig ikke muligt med sikkerhed at afgrænse de cerebrale strukturer, som er »minimalt tilstrækkelige og kollektivt nødvendige« for bevidsthedsfunktion [5]. Ikke desto mindre har man igennem de seneste to årtier kunnet afsløre vigtige fysiologiske og anatomiske aspekter af den raske hjernens bevidsthedsfunktion. Vi ved i dag, at de for bevidsthedsfunktionen så afgørende talamokortikale projektioner, som formidler information fra vores sanser til den sensoriske cortex (undtaget lugtesansen), etableres omkring svangerskabsuge 24 [6]. Funktionel billeddannelse og EEG-studier har endvidere afdækket betydningen af globale cerebrale netværk, herunder ventrale og dorsale netværk (f.eks.
ventral and dorsal stream), frontoparietale, laterale og mediale netværk (f.eks. task-positive og task-negative
eller default mode) [2] og det kortikotalamiske system [7] samt essentielle mekanismer såsom re-entrant versus feed-forward og top-down- versus bottom-up-styring og synkroniseringen af informationsudveksling på tværs af cerebrale netværk [2]. Bevidsthed, inklusive alle qualia, eksisterer uafhængigt af sprog [8], motorisk funktion [9], sensorisk input [10], søvn [11], hukommelse [12], visuospatiale referencer [13], selvrefleksion og opmærksomhed [5]. I Tabel 1 sammenfattes vigtige hypoteser om oprindelsen af hjernens bevidsthedsfunktion.
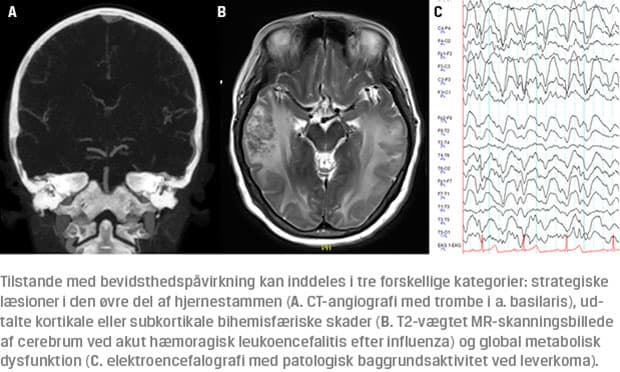
Ifølge Sundhedsstyrelsen diagnosticeres der årligt mere end 21.000 personer i Danmark, herunder over 1.000 børn, med en erhvervet hjerneskade. Mange af disse hjerneskader medfører tab af bevidsthedsfunktion. Tilstande med bevidsthedspåvirkning er koma, vegetativ status (unresponsive wakefulness syndrome (UWS)),
minimalbevidste tilstande (minimal conscious state (MCS)) samt tilstande, der ikke længere opfylder kriterierne for MCS, men som betegner tilstanden hos patienter, der stadig er svært kognitivt påvirkede (Tabel 2 og Figur 1).
Koma varer typisk ikke længere end mellem et par timer og to uger, eftersom patienten enten ikke overlever pga. udtalte hjernestammeskader eller vågner igen. Opvågning fra koma er kendetegnet ved øjenåbning og tilbagevenden af en søvn-vågenheds-cyklus. Hvis patienten kun viser refleksadfærd og ingen tegn til bevidsthedsfunktion, er der tale om en vegetativ status – et uheldigt begreb med en negativ konnotation, hvorfor det engelske begreb UWS er at foretrække [19]. Traditionelt betragtes tilstanden UWS som permanent, når der er gået tre måneder efter en ikketraumatisk og 12 måneder efter en traumatisk hjerneskade, men der rapporteres i stigende grad om tilfælde med senere tilbagevendende bevidsthed. Ved MCS udviser patienten utvetydige tegn på ikkerefleksadfærd som respons på eksterne stimuli – oftest ikke konsistent, men reproducerbart. Per definition er tovejskommunikation ikke mulig, men nogle patienter kan til en vis grad efterkomme enkle kommandoer. MCS-tilstanden kan således deles ind i MCS-plus og MCS-minus. MCS-minus betegner patienter, som registrerer og lokaliserer smerte, har visuelle følgebevægelser (undersøges bedst med et spejl [20]) og/eller udtrykker for situationen relevante følelser (f.eks. gråd ved tiltale fra pårørende), mens MCS-plus betegner patienter, som også er i stand til at efterkomme simple kommandoer – ikke altid, men reproducerbart. UWS og MCS er ikke skarpt afgrænsede tilstande, men dækker et spektrum. Patienter kan udvikle sig fra UWS til MCS eller bedre, men kan også vende tilbage til et lavere niveau; dvs. bevidstheden kan både tiltage og aftage over tid (Figur 2). Man skal derfor være klar over, at: 1) den enkelte undersøgelse kun viser et øjebliksbillede, 2) undersøgeren skal anvende så bredt et repertoire af stimuli som muligt
(f.eks. auditive, visuelle, taktile, nociceptive), og
3) vågenhedsgraden optimeres af emotionelt betydningsfulde stimuli (f.eks. tilstedeværelse af pårørende). Der er evidens for, at man ved en rutinemæssig neurologisk undersøgelse fejlagtigt klassificerer op til 40% af alle patienter med kronisk bevidsthedspåvirkning som værende i UWS [22]. Undervurdering af patientens bevidsthedstilstand er således snarere normen end undtagelsen, men den kan forebygges i et vist omfang ved gentagne evalueringer med standardiserede skalaer [23], hvoraf Coma-Recovery Scale-Revised er den mest valide [24].
Bevaret bevidsthedsfunktion kan således kun registreres ved hjælp af traditionelle kliniske undersøgelsesteknikker, hvis patienterne har motorisk funktion i en eller anden grad. Men hvad hvis enhver form for motorisk funktion er ophørt, og patienten dermed ikke kan give sig til kende for undersøgeren? Gennem de seneste 10-15 år har man derfor i stigende grad til undersøgelse af patienter med bevidsthedspåvirkning anvendt alternative metoder, som omfatter særligt funktionel MR-skanning (fMRI) og EEG. Disse metoder giver mulighed for at identificere patientens cerebrale reaktion, uden at man behøver at registrere et motorisk respons [25-27]. Nogle patienter, som klinisk er ukontaktbare (dvs. UWS), kan i realiteten deltage i mentale opgaver ved at modificere deres hjerneaktivitet, hvilket kan afsløres ved hjælp af fMRI og EEG. Ca. 15% af alle UWS-patienter, som undersøges med fMRI- og/eller EEG-baserede bevidsthedsparadigmer, efterkommer kommandoer ved at udføre mentale opgaver [21]. Denne tilstand har derfor fået betegnelser såsom kognitiv motordissociation eller komplet locked-in-syndrom [9, 18, 28] (Tabel 2). Det betyder, at disse patienter er klinisk fejldiagnosticerede og faktisk er ved bevidsthed (i det mindste på undersøgelsestidspunktet), hvilket er kritisk for prognose, behandling og ressourceallokering. Der er tre forskellige måder at anvende fMRI og EEG på ved undersøgelse af bevidsthedspåvirkede patienter: 1) aktive paradigmer: Patienten bliver opfordret til at udføre kognitive opgaver såsom at forestille sig at gå omkring i kendte omgivelser eller at spille tennis [1, 27]. 2) Passive paradigmer: Her registreres tilstedeværelsen eller fraværet af et komplekst cerebralt respons på eksterne stimuli som tegn på bevarede kortikale netværk. De mest brugte passive paradigmer er oddball paradigms, dvs. serier af identiske eksterne stimuli (f.eks. et neutralt navn), som i uregelmæssige intervaller brydes med en afvigende stimulus (f.eks. med patientens eget navn) [21]. 3) Resting state-paradigmer: Antagelser om patientens bevidsthedstilstand ekstrapoleres fra mønstre i den spontane hjerneaktivitet (f.eks. default mode-netværk) [29, 30]. Aktive paradigmer er meget specifikke, men ikke sensitive, eftersom de vil være falsk negative hos patienter, som ikke er i stand til at samarbejde på grund af afasi, eksekutiv dysfunktion, neglect, depression eller døvhed. Passive og resting state-paradigmer er givetvis mindre specifikke, men mere sensitive [21]. Eftersom en guldstandard for bevidsthedsfunktionen ikke eksisterer, er det ikke muligt nøjagtigt at kvantificere sensitivitet og specificitet af aktive, passive eller resting state-paradigmer. Det er imidlertid vigtigt at notere, at aktive EEG- og fMRI-baserede paradigmer giver positive resultater med tilsvarende frekvens, mens passive EEG-paradigmer næsten to gange oftere bliver fortolket som værende forenelige med bevaret bevidsthed, end fMRI-paradigmer bliver [21]. Serielle evalueringer er at foretrække, eftersom bevidsthedsfunktion er en højst fluktuerende tilstand (Figur 2), her har EEG-paradigmer den fordel, at logistikken er mindre kompliceret end ved fMRI-paradigmer.
EEG- og fMRI-baserede bevidsthedsparadigmer anvendes i dag næsten udelukkende i forskningsøjemed, men vil i fremtiden komme til at spille en vigtig rolle i den kliniske hverdag. Kan resultater fra EEG- og fMRI-paradigmer påvirke behandlingsbeslutninger i en forkert retning? Problemet kan opstå, hvis undersøgelserne fejlagtigt tyder på, at patienten er i UWS, mens vedkommende i virkeligheden har et bedre bevidsthedsniveau (falsk negativt resultat). Den kliniske evaluering er dog i sig selv behæftet med fejl, som anført ovenfor, og den teknologiassisterede evaluering er blot et komplement. Således afspejler det etiske dilemma, som en EEG- og fMRI-baseret vurdering medfører, blot de allerede kendte usikkerheder i den daglige kliniske beslutning. At estimere graden af patienternes bevidsthed og deres potentiale for at genvinde kognitiv funktion er blandt de største udfordringer for læger på intensiv- og rehabiliteringsafdelinger, og det er ikke mindst en væsentlig information for de pårørende. Enhver optimering af den diagnostiske sikkerhed er derfor velkommen. Prognostisk determinisme i forhold til patienter, hvis bevidsthedsfunktion er undervurderet, kan føre til terapeutisk nihilisme såsom fravalg af genoptræning og afslutning af livsopretholdende terapi.
Korrespondance: Daniel Kondziella.
E-mail: daniel_kondziella@yahoo.com
Antaget: 20. juli 2018
Publiceret på Ugeskriftet.dk: 1. oktober 2018
Interessekonflikter: ingen Forfatternes ICMJE-formularer er tilgængelige sammen med artiklen på Ugeskriftet.dk
Daniel Kondziella:
Human consciousness in health and disease
Ugeskr Læger 2018;180:V03180233
Functional neuroimaging, electroencephalography and clinical examination are essential to understand the many facets of disorders of consciousness.
Yet, it is still not widely known that patients exist who are clearly conscious but unable to show it owing to complete loss of motor output, a condition which has been termed cognitive motor dissociation. In this review, the mechanisms of normal and impaired consciousness are discussed, and current theories of consciousness, as well as specific clinical signs, which are essential to discern the state of consciousness in a given patient, are highlighted.
Owen AM, Coleman MR, Boly M et al. Detecting awareness in the vegetative state. Science 2006;313:1402.
Bodien Y, Chatelle C, Edlow B. Functional networks in disorders of consciousness. Semin Neurol 2017;37:485-502.
James W. The physical bases of emotion. 1894. Psychol Rev 1994;101:205-10.
Fischer DB, Boes AD, Demertzi A et al. A human brain network derived from coma-causing brainstem lesions. Neurology 2016;87:2427-34.
Crick F, Koch C. A framework for consciousness. Nat Neurosci 2003;6:119-26.
Lagercrantz H. The emergence of consciousness: science and ethics. Semin Fetal Neonatal Med 2014;19:300-5.
Flores FJ, Hartnack KE, Fath AB et al. Thalamocortical synchronization during induction and emergence from propofol-induced unconsciousness. Proc Natl Acad Sci 2017;114:E6660-8.
Taylor J. My stroke of insight: a brain scientist’s personal journey. Viking Penguin, 2006.
Schiff ND. Cognitive motor dissociation following severe brain injuries. JAMA Neurol 2015;72:1413.
Büchel C, Price C, Frackowiak RS et al. Different activation patterns in the visual cortex of late and congenitally blind subjects. Brain 1998;121:409-19.
Dresler M, Eibl L, Fischer CFJ et al. Volitional components of consciousness vary across wakefulness, dreaming and lucid dreaming. Front Psychol 2014;4:987.
Bartsch T, Deuschl G. Transient global amnesia: functional anatomy and clinical implications. Lancet Neurol 2010;9:205-14.
Robertson L. Space, objects, minds, and brains. Psychology Press, 2004.
Feinberg TE. The ancient origins of consciousness.. The MIT Press, 2017.
Schiff ND. Recovery of consciousness after brain injury: a mesocircuit hypothesis. Trends Neurosci 2010;33:1-9.
Dehaene S. Theorizing consciousness. I: Dehaene S, red. Conscious brain deciphering how brain codes our thoughts. Penguin Books, 2014:161-97.
Tononi G, Boly M, Massimini M et al. Integrated information theory: from consciousness to its physical substrate. Nat Rev Neurosci 2016;17:450-61.
Bayne T, Hohwy J, Owen AM. Reforming the taxonomy in disorders of consciousness. Ann Neurol 2017;82:866-72.
Laureys S, Celesia GG, Cohadon F et al. Unresponsive wakefulness syndrome: a new name for the vegetative state or apallic syndrome. BMC Med 2010;8:68.
Wannez S, Vanhaudenhuyse A, Laureys S et al. Mirror efficiency in the assessment of visual pursuit in patients in minimally conscious state. Brain Inj 2017;31:1429-35.
Kondziella D, Friberg CK, Frokjaer VG et al. Preserved consciousness in vegetative and minimal conscious states: systematic review and meta-analysis. J Neurol Neurosurg Psychiatry 2016;87:485-92.
Schnakers C, Vanhaudenhuyse A, Giacino J et al. Diagnostic accuracy of the vegetative and minimally conscious state: clinical consensus versus standardized neurobehavioral assessment. BMC Neurol 2009;9:35.
Wannez S, Heine L, Thonnard M et al. The repetition of behavioral assessments in diagnosis of disorders of consciousness. Ann Neurol 2017;81:883-9.
Seel RT, Sherer M, Whyte J et al. Assessment scales for disorders of consciousness: evidence-based recommendations for clinical practice and research. Arch Phys Med Rehabil 2010;91:1795-813.
Stender J, Gosseries O, Bruno M-A et al. Diagnostic precision of PET imaging and functional MRI in disorders of consciousness: a clinical validation study. Lancet 2014;384:514-22.
Edlow BL, Chatelle C, Spencer CA et al. Early detection of consciousness in patients with acute severe traumatic brain injury. Brain 2017;140:23-31.
Monti MM, Vanhaudenhuyse A, Coleman MR et al. Willful modulation of brain activity in disorders of consciousness. N Engl J Med 2010;362:579-89.
Kondziella D. Roald Dahl and the complete locked-in syndrome: “Cold dead body, living brain”. J Neurol Sci 2017;379:276-8.
Hannawi Y, Lindquist MA, Caffo BS et al. Resting brain activity in disorders of consciousness: a systematic review and meta-analysis. Neurology 2015;84:1272-80.
Kondziella D, Fisher PM, Larsen VA et al. Functional MRI for assessment of the default mode network in acute brain injury. Neurocrit Care 2017;27:1-6.