Et tilfælde af toksisk encefaloneuropati under behandling med nimorazol

Shanga Hassan Qadir1, Ruta Jakubauskaite2 & Emilie Lund Laursen1
5-nitroimidazoler (5-NI) omfatter, udover antibiotika som metronidazol (MI), bl.a. stoffet nimorazol (NI), der anvendes som hypoxisk radiosensibilisator i behandlingen af planocellulært hovedhalskarcinom. Ved at øge de cytotoksiske effekter af ioniserende stråling på tumorceller er NI i et dansk studie vist at forbedre den 5-årige lokoregionale kontrol ved pharynx- og supraglottisk karcinom fra 33% til 49% sammenlignet med placebo, uden øget skade på normalt væv [1].
MI-induceret encefalopati (MIE) er en sjælden tilstand men veldokumenteret i litteraturen med klassiske radiologiske fund [2]. Neurotoksicitet induceret af NI er derimod yderst sjældent og ikke tidligere beskrevet i svær grad.
Den potentielle neurotoksicitet kan skyldes, at 5-NI er lipofile, krydser blodhjernebarrieren og opnår høje koncentrationer i hjernen [3]. 5-NI påvirker hjernens energimetabolisme, hvilket er ønskværdigt i tumorbehandling, men den særlige sårbarhed i cerebellum og hjernestamme over for energimangel gør disse regioner til prædilektionssted for neurotoksicitet.
NI anses generelt for at have få alvorlige bivirkninger [4]. I et engelsk studie blev 338 patienter randomiseret til strålebehandling med enten NI eller placebo uden registrering af svære neurologiske bivirkninger [5]. NI kan derfor overses som årsag til neurologiske symptomer hos patienter med hoved- og halskræft.
En 54-årig kvinde, ikke-ryger, uden komorbiditet eller alkoholoverforbrug, blev tilset på neurologisk tilsyn pga. subakut opstået desorientering, sløvhed, dysartri og ustabil gang. Patienten var i kurativt intenderet strålebehandlingsforløb for nydiagnosticeret tungerodskræft. Hun havde på tidspunktet for neurologisk tilsyn gennemført 30 af 33 planlagte strålebehandlinger. Patienten blev forbehandlet med 2,5 g NI pr. strålebehandling som radiosensibilisator (kumuleret dosis på 75 g i forløbet) i overensstemmelse med danske retningslinjer [1]. Patienten modtog desuden fire doser cisplatin som kemoterapeutikum. Hun var ikke i behandling med andre lægemidler.
Objektivt fremstod patienten orienteret, men træg og emotionelt påfaldende i kontakten. Talen var dysartrisk, gangen bredsporet og usikker og Rombergs test positiv. Der blev ikke påvist afasi, kranienervepåvirkning eller sensorimotoriske udfald. Over de følgende dage progredierede symptomerne med markant talelatens, svær dysfagi, trunkal instabilitet, ataksi i overekstremiteterne, opbrudte øjenbevægelser, tungedysdiadokokinese og nedsat sensibilitet for stik og vibration i underekstremiteterne til ankelniveau.
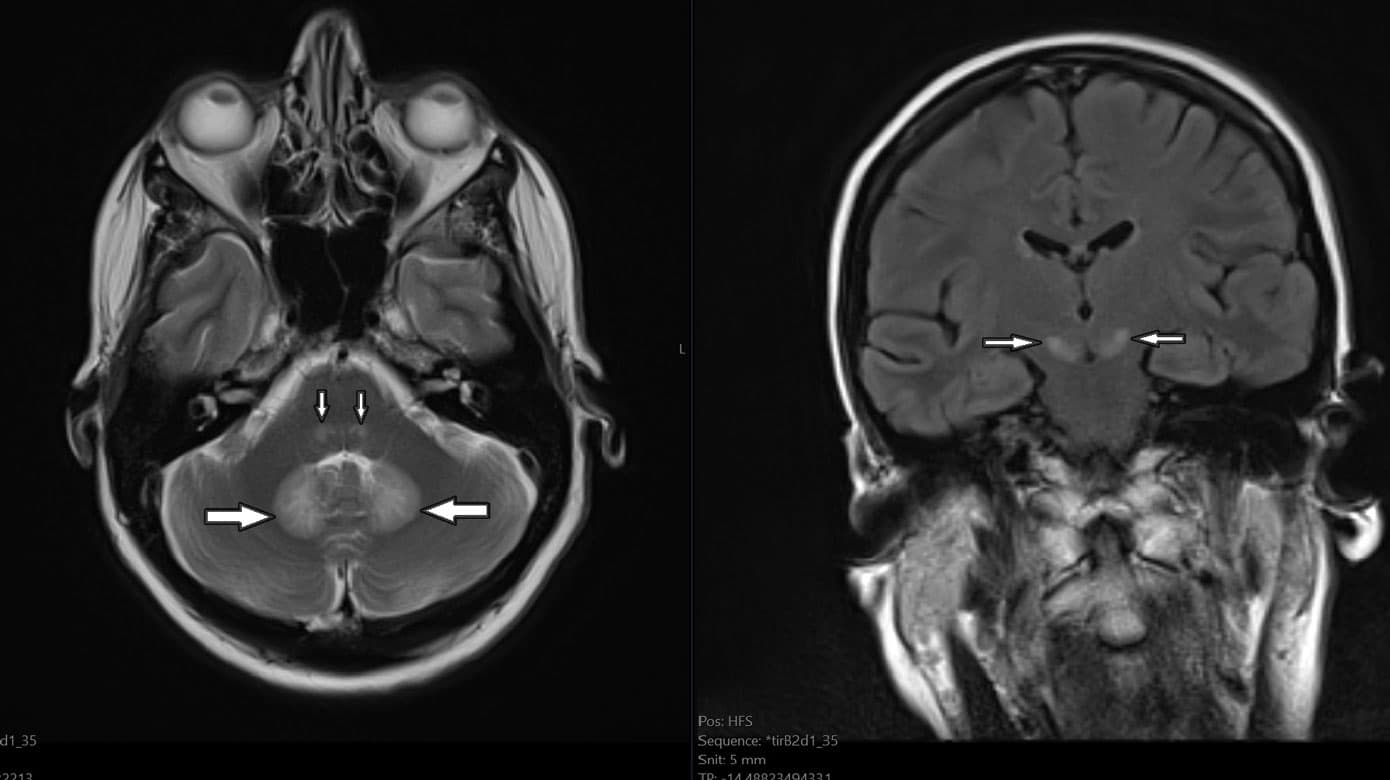
Blodprøver, inkl. paraneoplastiske antistoffer og levertal, var normale og bloddyrkning var uden vækst. Neurofysiologi viste aksonal sensorisk polyneuropati med fravær af sensoriske signaler i n. suralis og n. peroneus bilateralt og nedsat amplitude i venstre n. medianus og n. radialis. Cerebrospinalvæske viste normalt celletal, protein og laktat. BioFire-panel var negativt, herpes simplex-virus- og varicella-zoster-virus-intratekal test var negativ, og cytologisk cerebrospinalvæskeundersøgelse viste intet malignitetssuspekt. CT af cerebrum med kontrast viste intet abnormt, specielt ingen tegn på intrakraniel indvækst af primærtumor. MR-skanning af cerebrum viste fund som beskrevet i Figur 1 A + B. Et identisk MR-billede er velbeskrevet ved metronidazolinduceret encefalopati.
Baseret på det kliniske billede og radiologiske fund (Figur 1) blev toksisk encefalopati forårsaget af NI vurderet som den mest sandsynlige diagnose, og behandlingen blev seponeret. Alle radiologiske fund remitterede fuldstændigt inden for fire uger efter ophør med NI, bekræftet ved en opfølgende normaliseret MR-skanning af cerebrum. De kliniske centralnervesystem (CNS)-symptomer remitterede i samme periode, hvorimod den perifere neuropati, mere sandsynligt forårsaget af cisplatin end NI, persisterede.
En helkrops-18F-fludeoxyglucose (FDG)-PET/CT tre måneder senere bekræftede komplet strukturel og metabolisk remission af kræftsygdommen. Patienten opnåede samlet set betydelig bedring efter 18 mdr. og vendte tilbage til fuldtidsbeskæftigelse.
NI er en effektiv hypoxisk radiosensibilisator i behandlingen af hoved- halskræft, men den sjældne risiko for neurotoksicitet bør ikke undervurderes. Det kliniske billede kan sløres hos en del patienter og særlig ved komorbide tilstande, såsom langvarigt alkoholoverforbrug, der kan medføre metabolisk påvirkning af CNS.
Den beskrevne case afspejler de kliniske og radiologiske kendetegn, man klassisk ser ved MIE og understreger behovet for øget opmærksomhed på, at andre nyligt opstartede 5-NI kan forårsage et lignende billede. Tidlig seponering af 5-NI kan føre til fuld remission af centrale neurologiske symptomer, hvilket understreger vigtigheden af rettidig diagnose og intervention.
Korrespondance Shanga Hassan Qadir. E-mail: Shanga.hassan.qadir.01@regionh.dk
Antaget 10. april 2025
Publiceret på ugeskriftet.dk 14. juli 2025
Interessekonflikter ingen. Alle forfattere har indsendt ICMJE Form for Disclosure of Potential Conflicts of Interest. Disse er tilgængelige sammen med artiklen på ugeskriftet.dk.
Referencer findes i artiklen publiceret på ugeskriftet.dk
Artikelreference Ugeskr Læger 2025;187:V12240878
doi 10.61409/V12240878
Open Access under Creative Commons License CC BY-NC-ND 4.0
5-nitroimidazoles (5-NI) are pharmacologically diverse drugs used mainly for anaerobic and parasitic infections. Metronidazole is the most widely used 5-NI and has rare neurotoxic effects, including cerebellar and brainstem dysfunction, encephalopathy, and seizures. Other (5-NI) have been studied as hypoxic cell radiosensitizers but are limited by dose-dependent side effects. Nimorazole is in use in Denmark for head-and-neck cancer and is considered safe. No cases of nimorazole-induced neurotoxicity like Metronidazole encephalopathy have been published. In this case, we report a patient who developed toxic encephaloneuropathy during nimorazole radiosensitisation.