Fordele og ulemper ved anvendelse af autologe versus allogene stamceller til behandling af artrose

Jasmin Bagge1, Kristine Freude2, Casper Lindegaard3, Bjørn Holst4 & Per Hölmich1
Hovedbudskaber
Artrose er en smertefuld, degenerativ og inflammatorisk ledsygdom. Der findes desværre ingen behandling, som effektivt kurerer eller bremser sygdommen, men i de seneste årtier har behandling med mesenkymale stamceller (MSC’er) vist lovende resultater for ledheling, forsinkelse af sygdomsudvikling og smertelindring [1-3]. Studier har vist, at MSC’er fungerer ved direkte differentiering, ved parakrin aktivering af lokale progenitorceller og ved at modulere immunforsvaret, således at miljøet bliver mere favorabelt for heling [3, 4]. I klinikken anvendes primært autologe MSC’er til artrosebehandling, men problemstillinger relateret til celleopformering [5], patientens alder [6] og akutte behandlinger har åbnet for ønsket om allogen terapi.
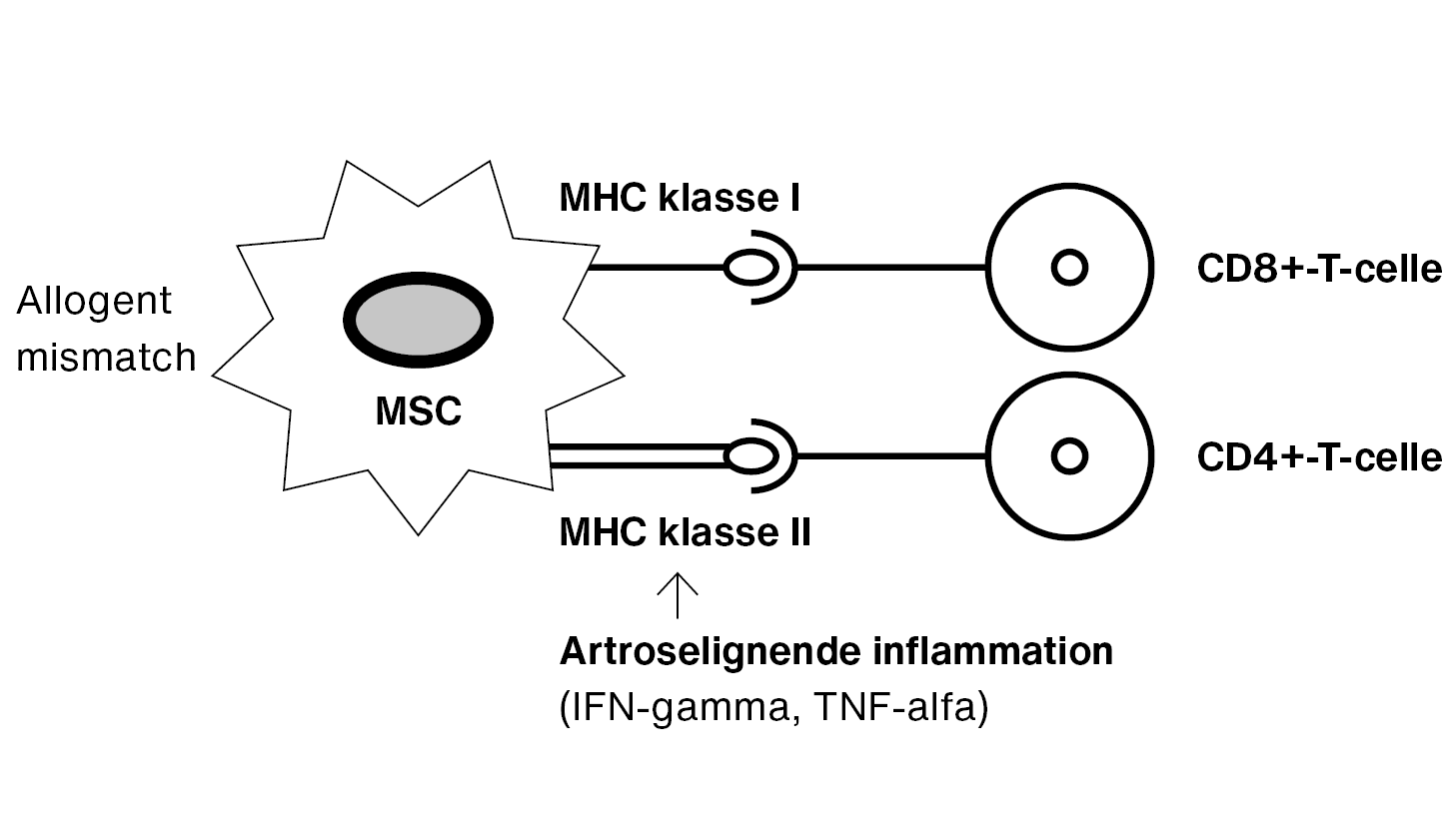
En udfordring ved allogene transplantationer er en potentiel, immunologisk fremmedlegemereaktion, der initieres, når modtagerens immunceller genkender major histocompatibility complex (MHC) på celleoverfladen som værende forskellig fra dens egen. Der findes to MHC-klasser (I og II), som deles op i flere humant leukocytantigen-subklasser [7].
MSC’er antages historisk at være frie for MHC klasse II samt at have meget lave niveauer af MHC klasse I, hvormed de kan undslippe/minimere T-cellegenkendelse og et uønsket immunrespons, hvilket teoretisk tillader allogen stamcelleterapi. Nyere studier har imidlertid vist, at dette desværre ikke altid er tilfældet, da heterogene typer af MHC klasse I og klasse II er identificeret på overfladen af MSC’er [8]. In vitro-studier har vist en opregulering af MHC klasse II hos MSC’er efter stimulering med inflammatoriske faktorer, som er eleveret i artroseled [8, 9]. Et MHC-mismatch kan forårsage en immunologisk reaktion ved allogen terapi, hvilket er vist ved repetitive behandlinger allerede ved første til anden behandling (Figur 1) [10-12].
Der arbejdes i øjeblikket på allogene, kommercielt tilgængelige humane stamcelleprodukter til behandling af artrose i EU, og disse findes allerede tilgængelige i Asien og på det veterinære marked i EU. Den stigende anvendelse af autolog og allogen stamcellebehandling til patienter med artrose vigtiggør en evidensbaseret diskussion af relaterede fordele og ulemper samt faktorer, der skal overvejes for at udvælge den mest egnede behandling til den enkelte patient. Formålet med denne statusartikel er derfor at belyse disse forhold.
MSC’er høstet fra forskellige typer væv, herunder fedtvæv og knoglemarv, anvendes til intraartikulær behandling af artrose. Kliniske studier indikerer en positiv effekt med lavere smertescore, mindsket brusknedbrydelse og i enkelte studier en øget, regenerativ bruskdannelse [13-15]. På nuværende tidspunkt anvendes primært autolog MSC-behandling til patienter med artrose, hvor stamcellerne høstes fra patienten selv. Stamcellerne bliver herfra enten anvendt i en one-step procedure direkte på operationsstuen, som eksempelvis mikrofragmenteret fedtvæv og opkoncentrerede knoglemarvsaspirater, eller anvendt efter en yderligere oprensning og opformering i laboratoriet. Antallet af stamceller er relativt lave ved one-step procedurerne (typisk < 1 × 106) [16] sammenlignet med behandling med opformerede MSC’er (typisk 10-100 × 106) [2].
MSC-dosis-respons-studier på opformerede celler har vist en bedre, langvarig effekt af højere doser ved artrosebehandling [2, 17]. MSC-behandling kan derfor potentielt forbedres af en in vitro-opformering af cellerne inden injektion. En opformering af cellerne kræver et good manufacturing practice-laboratorie samt adskillige regulatoriske tilladelser. Hertil er celleopformering tidskrævende og omkostningstung, hvorved akutte behandlinger med opformerede autologe celler udelukkes. Dette kan være problematisk, da MSC-behandling af artrose har vist bruskbeskyttende og regenererende resultater primært i tidlige artrosestadier [17]. Studier har ydermere vist, at MSC’er har en begrænset evne til at dele sig, og at et højt antal celledoblinger negativt påvirker MSC’erne, således at de ikke længere kan danne brusk og knoglevæv, men i stedet bliver »gamle« (senescente) og udskiller hæmmende signalstoffer til omkringliggende celler [5]. Antallet af celler skal derfor være højt nok i udgangsmaterialet, til at en storskalaproduktion ikke er skadelig for cellerne.
Den begrænsede opformeringsevne af MSC’erne kan være problematisk ved et højt cellebehov ved repetitive behandlinger med autologe højdosis-MSC’er, som muligvis kan forlænge en positiv behandlingseffekt [17]. I et fase I/II-RCT har Matas et al vist, at to MSC-behandlinger af knæartrose, givet med seks måneders mellemrum, havde en bedre effekt på smertescorer end en enkelt behandling ved 12-måneders followup [1]. Freitag et al fandt imidlertid ingen forskel i smertescore ved sammenligning af en eller to MSC-behandlinger af knæartrose [18]. Studiet af Freitag et al anvendte dog fem gange så mange MSC’er (100 × 106) som anvendt af Matas et al (20 × 106), hvilket kan være en medvirkende faktor.
Adskillige studier har vist et fald i MSC-kvantiteten og -kvaliteten med stigende donoralder, hvor et markant fald typisk rapporteres omkring 50-årsalderen [19, 20]. Enkelte studier har ikke påvist nogen alderseffekt [21], og fedtvævs-MSC’er er fundet mindre følsomme for aldring sammenlignet med knoglemarvs-MSC’er [6, 22]. Antal celler og celleopformering kan således være en begrænsende faktor ved autologe behandlinger, hvorimod det er en mindre udfordring ved allogene behandlinger, hvor celler kan anvendes fra flere (yngre) donorer. Patientens alder bør derfor tages i betragtning ved autolog behandling og valg af stamcelletype, hvilket kan være en udfordring, da artrose hyppigt forekommer hos ældre patienter.
Klare fordele ved autolog terapi er en minimeret risiko for fremmedlegemereaktioner og intet behov for at screene for donorkompatibilitet (Tabel 1). Ved lukkede, autologe one-step procedurer er der færre påkrævede regulatoriske tilladelser og en mindre infektionsrisiko end ved dyrkede celler. Et systematisk review af Wiggers et al inkluderede 14 RCT’er af autolog MSC-behandling på 408 patienter med knæartrose, hvor der blev givet en (79%), to (14%) eller tre (7%) intraartikulære behandlinger [14]. Studiet viste, at resultaterne af 19 ud af 26 (73%) patient-reported outcome measurements (PROM) var signifikant forbedrede ved MSC-behandling sammenlignet med kontrolgruppen et år efter behandling. RCT’erne var generelt af varierende kvalitet og flere med høj risiko for outcome bias, men essentielt blev ingen væsentlige bivirkninger af autolog MSC-behandling rapporteret i nogen af RCT’erne op til fire år efter behandling.
I en hestemodel blev levende, autologe MSC’er identificeret lokalt omkring injektionsstedet i en sene ni uger efter behandling ved brug af MR-skanning og histologi. Dette understøtter, at autologe MSC’er ikke nedbrydes af immunsystemet, og at der er en minimal risiko for fremmedlegemereaktioner [23].
En kommercielt tilgængelig, allogen MSC-behandling af artrose vil være attraktiv. En enkelt injektion af allogene MSC’er er i flere artrosestudier anvendt med klinisk forbedring og uden væsentlige bivirkninger [17, 24-26]. Et review af Copp et al viste, at fem ud af seks (83%) kliniske artrosestudier med allogen, opformeret MSC-behandling resulterede i signifikante PROM-forbedringer. Dette tal var otte af ni (89%) ved behandling med autologe MSC’er [17]. Et studie af Frisbie et al rapporterede dog et bedre regenerativt respons på en bruskskade med øget osteofyt- og bruskdannelse ved en enkelt injektion af autologe MSC’er sammenlignet med allogen MSC-behandling, der på de fleste parametre ikke var signifikant bedre end injektion udelukkende med fibringel [27]. Et fase I-studie af de Windt et al har ydermere vist, at regenerativt væv opnået ved behandling af bruskskader med allogene MSC’er udelukkende bestod af patientens eget DNA, og at de allogene MSC’ers primære effekt udførtes via parakrin signalering [26].
Et MHC-mismatch er dog vist at kunne forårsage en immunologisk reaktion ved repetitiv, allogen behandling [1, 10-12, 28]. Bivirkninger ved allogen MSC-behandling inkluderer ledsmerte, hævelse i leddet, urticaria og MSC-ødelæggelse. Dette er problematisk, da repetitive MSC-behandlinger af artrose potentielt har bedre langsigtede resultater [1, 17].
MSC’er kan herudover opregulere deres MHC klasse II-ekspression, hvis de udsættes for artroselignende, inflammatoriske stimuli [8, 9]. Et studie af Oh et al viste, at 1,1% af humane knoglemarvs-MSC’er havde MHC klasse II på deres overflade under normale vækstforhold, men at dette blev opreguleret til 28,7% af MSC’erne efter inflammatorisk stimulering med tumornekrosefaktor-α, der findes i forhøjet koncentration i artroseled [9]. Dette problematiserer brugen af udelukkende MHC klasse II-negative MSC’er til allogen behandling, da MSC’erne vil blive udsat for inflammation efter injektion i et artroseled. Genetisk manipulation med knockout af MHC klasse I og klasse II, så dette gen ikke længere eksisterer hos MSC’erne, har dog vist potentiale for MSC-overlevelse efter transplantation til et mismatch af immunkompetente mus [29].
Haplotypning og match af patient og donor er mulig før behandling, men inkluderer en tidskrævende og omkostningstung proces, hvorfor dette på nuværende tidspunkt ikke udføres i kliniske artrosestudier med allogene celler. Allogen terapi indeholder herudover ofte MSC’er fra flere donorer grundet den begrænsede MSC-opformeringsevne, hvilket besværliggør et fuldt match. Velkarakteriserede stamcellebanker kunne være med til at løse problemet.
Cellehukommelse vurderes yderligere at være en årsag til allogene fremmedlegemereaktioner. I 2014 viste Ryan et al, at differentiering af MSC’er til bruskceller forårsagede en ændring i deres genudtryk til den donor, som de kom fra, i en allogen rottemodel, hvormed de også mistede deres immunsuppressive evne og blev nedbrudt af et allogent, T-celleinitieret immunrespons. Differentierede, humane MSC’er mistede også deres immunsuppressive evne in vitro. Udifferentierede MSC’er forårsagede signifikant mindre immunrespons i rottemodellen [30], men ved regenerativ artrosebehandling ønskes umiddelbart en høj differentieringsevne af MSC’erne, der sammenholdt med deres parakrine signalering kan fremme regeneration af leddet. En uønsket immunsuppressiv steroidbehandling kan være påkrævet for at mindske risikoen for fremmedlegemereaktioner.
Fordele ved allogen terapi er en mere standardiseret og testet behandling, der hurtigt kan anvendes – helst fra optimale donorer. Udvælgelse af MSC’er fra (yngre) donorer med et højt stamcellepotentiale er mulig, hvilket potentielt kan forbedre behandlingseffekten hos (ældre) patienter med artrose. En storskalacelleopformering til kommerciel brug er herudover mulig med celler fra flere donorer (Tabel 1).
Behandling af artrose med autologe og allogene MSC’er har vist lovende, men varierende resultater. Dette kan muligvis skyldes forskelle i studiedesign, patientalder, høstningsvæv og -metode, MSC-dosis, antal behandlinger m.m. Anvendelse af autologe MSC’er er rapporteret at være sikkert for patienten, hvorimod immunologiske fremmedlegemereaktioner kan forekomme ved allogen behandling, specielt ved repetitive injektioner. En enkelt allogen MSC-behandling kan overvejes ved udfordringer med autolog behandling som eksempelvis høj patientalder og akut behandlingsbehov. På nuværende tidspunkt er der ikke entydige resultater vedrørende generaliseret brug af autolog eller allogen MSC-behandling af patienter med artrose. Behandling af artrose med MSC’er må fortsat betragtes som eksperimentel og bør kun tilbydes i kontrollerede setupper med struktureret opfølgning af patienterne.
Korrespondance Jasmin Bagge. E-mail: jasmin.bagge@regionh.dk
Antaget 6. november 2023
Publiceret på ugeskriftet.dk 1. januar 2024
Interessekonflikter ingen. Forfatternes ICMJE-formularer er tilgængelige sammen med artiklen på ugeskriftet.dk
Referencer findes i artiklen publiceret på ugeskriftet.dk
Artikelreference Ugeskr Læger 2024;186:V06230423
DOI: 10.61409/V06230423
Open Access under Creative Commons License CC BY-NC-ND 4.0
Jasmin Bagge, Kristine Freude, Casper Lindegaard, Bjørn Holst & Per Hölmich
Ugeskr Læger 2024;186:V06230423
Intraarticular treatment of osteoarthritis with mesenchymal stem cells (MSCs) has shown promising results and is being increasingly implemented in the clinic. Autologous MSCs are the primary source of therapy but issues related to cell expansion, patient age, and acute therapies have opened a need for allogenic MSCs. Problematic immunological reactions such as pain, joint swelling, urticarial, and MSC destruction are, however, reported when using allogenic MSCs at the first to second treatment. Multiple factors need to be considered when deciding on autologous or allogenic MSC treatment, as argued in this review.