Forebyggelse og behandling af højdesyge

Anders Blom Nathansen & Ann Merete Møller
Hovedbudskaber
Formålet med denne artikel er at undersøge relevant litteratur samt sammenfatte diagnostiske kriterier og anbefalede forebyggelses- og behandlingsmuligheder for de tre ovennævnte former for højdesyge. Disse tilstande forekommer naturligvis ikke i Danmark, men denne artikel kan bruges til at vejlede personer, som rejser til højderne.
AMS er den mest benigne form for højdesyge, 10-25% af alle, der bevæger sig > 2.500 m, oplever en mild form for AMS. Incidensen > 4.500 m vurderes at være 50-85% med forøget risiko ved hurtig opstigning [2]. Symptomerne er hovedpine, kvalme, svimmelhed, træthed og i nogle tilfælde opkastning. Symptomerne begynder typisk 6-12 t. efter ankomst til højderne og tager derefter gradvist til i styrke. AMS er en klinisk diagnose, der kan vurderes ud fra Lake Louise scoresystemet (LLS) [3]. Hvert symptoms sværhedsgrad vurderes på en skala fra 0 til 3 (0 ingen ubehag, 1 mildt ubehag, 2 moderat ubehag og 3 svært ubehag, ud fra patientens egen vurdering). En score på > 3 er klassificeret som AMS.
HACE udvikles ofte i forlængelse af AMS, og denne livstruende tilstand kræver hurtig behandling. Diagnosen stilles, hvis en person med AMS pludselig ændrer adfærd eller udvikler ataksi. Tilstanden forekommer også uden foregående AMS; ophold i højderne er naturligvis et krav. Foruden symptomer, som er kendt fra AMS, er andre tegn på HACE papilødem, øget intrakranielt tryk, hemiplegi/hemiparese og blødninger i retina. Tilstanden udvikles fra svær AMS i løbet af 1-3 dage og vil uden behandling ende med koma og slutteligt incarceration [4]. Det er vigtigt at udelukke differentialdiagnoser som dehydrering, hypotermi, apopleksi og hypoglykæmi [5]. Incidensen af HACE hos trekkere i Nepal i 4.243-5.500 meters højde skønnes at være omkring 1% med en prævalens på 3,4% hos personer med AMS [5]. For at stille den endelige diagnose kræves en MR-skanning.
HAPE opstår typisk inden for de første fire dage efter rejse til højderne og opstår sjældent < 3.000 m. Richalet et al fandt i et kohortestudie en incidens af HAPE på 1,7% hos 1.326 personer, som rejste til højder > 4.000 m. Det skal dog nævnes, at 17% af disse tidligere havde oplevet svære tilfælde af AMS og/eller HACE/HAPE [6]. I tilfælde, hvor nedstigning eller korrekt behandling af HAPE ikke er muligt, har man fundet en dødelighed på 50% [7].
Diagnosen HAPE bygger på LLS-kriterierne, som blev udarbejdet på et symposium i 1992: Dette indebærer mindst to af følgende symptomer: hviledyspnø, hoste, svaghed eller nedsat performance og brystspændinger. Derudover mindst to af følgende tegn: krepitationer eller hvæsen ved stetoskopi, central cyanose, takypnø og takykardi [8].
Den primære årsag til udvikling af AMS er et lavt O2-tryk i den omgivende luft, hvilket fører til akut hypoksi.
I takt med højdeforøgelsen og faldet i blodets partielle ilttryk PaO2 igangsættes hyperventilation, hvilket fører til en udvaskning af CO2. Den respiratoriske alkalose, som herved opstår, vil blive forsøgt kompenseret renalt med en forøget udskillelse af HCO3-. I et studie fandt man, at den renale kompensation indtræffer efter dage til uger, afhængigt af opstigningsprofilen [9].
På Figur 1 ses, at iltsaturationen falder i takt med højdeforøgelsen. På trods af en øget ventilation vil blodet desaturere. Dette fører til et øget cerebralt blodflow, som menes at bidrage til udviklingen af AMS. Den eksakte patogenese er ikke klarlagt, ødem bidrager muligvis. Der er fortsat tvivl om, hvorvidt der er tale om vasogen lækage og dermed et ekstracellulært ødem eller et øget cellulært optag af væske pga. forstyrrelse af Na+/K+-ATPasen. En blanding af disse to tilstande, som forværrer hinanden, er også mulig.
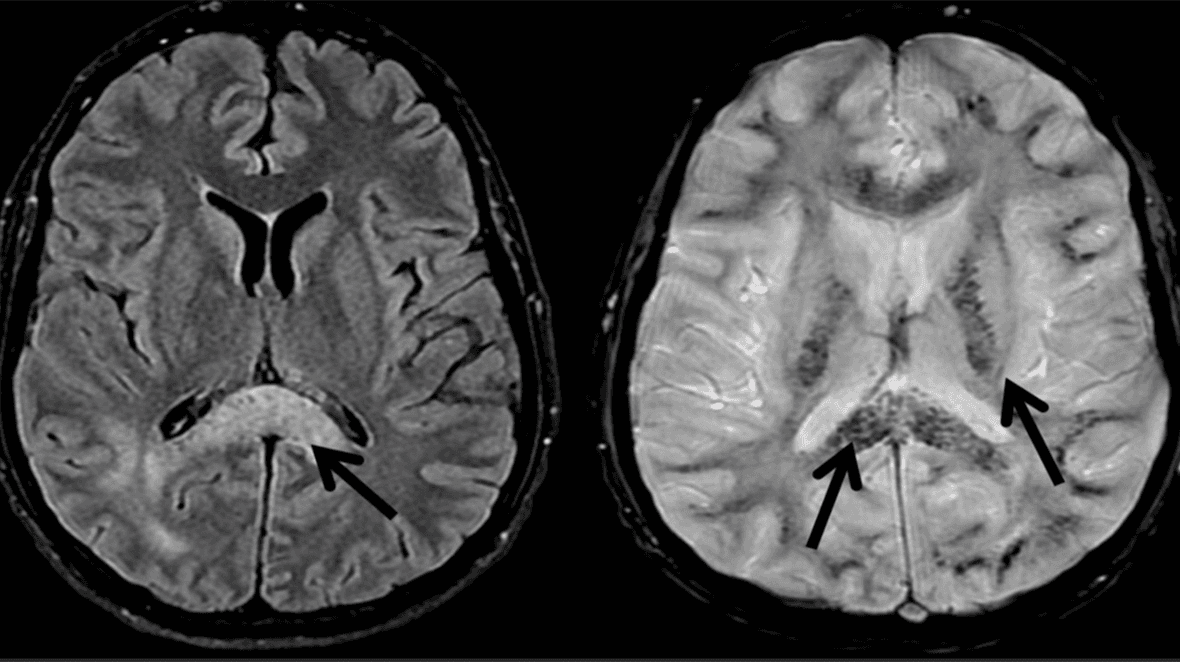
Da HACE muligvis at være en videreudvikling af svær AMS, har de to tilstande til dels den samme patogenese. Man ved ikke, hvorfor nogle patienter med AMS remitterer, og andre udvikler HACE. Individuel disposition og tilbøjelighed til HACE spiller muligvis en afgørende rolle. Ved MR-skanning har man fundet vasogent ødem, især i splenium i corpus callosum (Figur 2) [5]. Dette stemmer overens med de symptomer, som skade på splenium giver [10]. Vasogent ødem kan bekræftes måneder efter remission, hvor man har fundet hæmosiderin, et udtryk for en utæt af blod-hjerne-barriere (Figur 2). Ikke sjældent har man, ved obduktion eller røntgenundersøgelse af thorax, fundet lungeødem. Disse patienter har således haft både HACE og HAPE [4].
Alveolær hypoksi fører til en hypoksisk pulmonal vasokonstriktion [7]. Dette er et normofysiologisk respons, som i mange tilfælde øger saturationen, da det afiltede blod herved shuntes til veloxygenerede segmenter. Normalt kan dette ske uden en forøgelse af det pulmonale blodtryk [11]. Et lavt partialtryk af O2 vil medføre en global arteriel vasokonstriktion i det pulmonale kargebet, hvorved der sker en forøgelse af det pulmonale blodtryk. Dette fører til kapillær lækage til interstitiet og alveolerne [1]. Man mener samtidig, at en for lav produktion af nitrogenoxid (NO) er forbundet med vasokonstriktionen, da man har målt lave koncentrationer af NO i eksspirationsluften hos patienter med HAPE. Man har i højderne fundet pulmonale mean arterial tryk på 60 mmHg (spændvidde: 35-115 mmHg) hos forsøgspersoner [12]. Blodtrykstigningen menes at være ætiologien bag HAPE, hvorfor den farmakologiske behandling netop sigter mod at sænke det pulmonale arterielle tryk.
Den bedste måde at forebygge højdesyge, herunder AMS, er langsom og trinvis opstigning, hvorved kroppen får tid til at akklimatisere og dermed vænne sig til det faldende ilttryk. Anbefalingen fra Wildernes Medical Association lyder på en maksimal stigning på 500 m pr. dag, hvis man opholder sig i > 3.000 m højde. Det vigtigste er sovehøjden, mens det er mindre vigtigt, hvilken højde man opholder sig i de vågne timer [13]. Det anbefales også, at man holder en hviledag hver 3.-4. dag, man opholder sig i samme højde. AMS er i de fleste tilfælde selvlimiterende, hvis man sørger for at få hvile, og profylakse er således normalt ikke nødvendig hos personer med lav risiko, se Figur 3 [5, 14]. Det vigtigste er ikke at foretage yderligere opstigning før symptomophør. AMS kan til dels forebygges med farmaka, kulsyreanhydrasehæmmeren acetazolamid er førstevalgspræparatet og bruges ligeledes ved erkendt AMS. Forslag til profylakse og behandling fremgår af Tabel 1. Acetazolamid virker ved at hæmme kulsyreanhydrasen, som blandt andet findes i glomeruli. Dette hæmmer genoptag og fører til en øget renal udskillelse af bikarbonat. Herved opstår der en mild metabolisk acidose, som modvirker den respiratoriske alkalose, der opstår ved ophold i højderne. På denne måde kan akklimatisering fremskyndes. Anbefalingen lyder på 250 mg/dag fordelt på to doser [2, 15]. Ved svære tilfælde med en LLS > 6 kan dexamethason tillægges.
Det kan tilføjes, at flere og flere ældre med betydende komorbiditet er begyndt at rejse til højderne. Et eksempel på dette kunne være folk med KOL. Det er blevet påvist, at acetazolamid også har en positiv profylaktisk effekt hos denne patientgruppe [16].
Nonfarmakologisk behandling af erkendt højdesyge bygger overvejende på klinisk erfaring. Behandling med et mobilt hyperbart kammer anbefales ved svær AMS, men må ikke forsinke nedstigning. O2-tilskud kan også blive nødvendigt. Milde symptomer som hovedpine og kvalme kan behandles med paracetamol og ibuprofen. I [17] blev det påvist, at paracetamol og ibuprofen var lige effektive ved behandling af high-altitude headache. Med bivirkningsprofilerne in mente er paracetamol at foretrække.
Ved neurologiske symptomer som ataksi og ændret personlighed eller bevidsthed er der mistanke om udvikling af den højmaligne tilstand HACE [4]. HACE er oftest dødelig inden for 24 t., hvis korrekt behandling ikke er startet inden [18]. Dette indebærer passiv nedstigning til lavest mulig højde, O2-behandling 2/4 l/min eller brug af et hyperbart kammer. Den farmakologiske behandling indebærer behandling med i.v. givet dexamethason hvis muligt. Koma kan fortsætte i dage – selv efter nedstigning. Sequelae i uger efter HACE er normalt, men fuld remission er ikke sjælden.
Umiddelbart gælder samme råd ang. HAPE som for de to førnævnte tilstande. Hvis man tidligere har fået diagnosticeret HAPE, har man øget risiko for at få det igen. Profylakse med nifedipin har vist sig at være effektiv mod HAPE hos personer, som har fået stillet diagnosen før [7].
Til behandling af erkendt HAPE anbefales 1.000 meters nedstigning eller til symptomophør. Hvis nedstigning ikke er muligt, er O2-tilskud at foretrække. Behandling med hyperbart kammer er også anbefalet, men skal kun fungere som erstatning, indtil evakuering er mulig. Nifedipin kan også gives, men studier har vist, at indlæggelser og tid inden remission ikke forkortes hos patienter, der samtidigt behandles med O2. Nifedipin har således ikke nogen sikker virkning ved HAPE. PDE5-hæmmerne sildenafil og tadalafil gives som sidste mulighed, hvis ovennævnte tiltag ikke er tilgængelige.
Forebyggelsen af disse tilstande er vigtig at have sat sig ind i inden rejse til højderne. Her skal man kende en korrekt opstigningsalgoritme og kende til faresignaler på højdesyge, oftest viser AMS sig tidligst, og dette er et tegn på, at man skal have hvile.
HAPE og HACE bør behandles tidligt, hvis der opstår symptomer herpå, her bør passiv nedstigning være første prioritet, og anden behandling må ikke forsinke nedstigning. Denne artikel kan bruges til at hjælpe sundhedspersonale med at vejlede personer, der rejser til højderne.
Korrespondance Anders Blom Nathansen. E-mail: anders.blom@hotmail.com
Antaget 9. februar 2023
Publiceret på ugeskriftet.dk 27. marts 2023
Interessekonflikter ingen. Forfatternes ICMJE-formularer er tilgængelige sammen med artiklen på ugeskriftet.dk
Referencer findes i artiklen publiceret på ugeskriftet.dk
Artikelreference Ugeskr Læger 2023;185:V06220421
Anders Blom Nathansen & Ann Merete Møller
Ugeskr Læger 2023;185:V06220421
More and more people travel to high altitudes, some develop mountain sickness, a possible life-threatening condition. The most common and benign case of mountain sickness is acute mountain sicknes, this condition is easily treatable by descending or low dose aceatazolamide. Treatment is important to avoid development to the more severe cases of mountain sickness high-altitude cerebral oedema and high-altitude pulmonary oedema. These conditions require early recognition and treatment. This review gives an overview of available treatment of these conditions and how to avoid them in the first place.