Forhøjet intrakranielt tryk ved akut bakteriel meningitis

Christine Lodberg Hvas1, 2, Åse Bengård Andersen3, Kirsten Møller4, Klaus Hansen5, Frantz Rom Poulsen6, 7, 8 & Christian Overgaard-Steensen9
Hovedbudskaber
Ændret bevidsthed ved akut bakteriel meningitis skyldes som udgangspunkt forhøjet intrakranielt tryk (ICP).
CT af cerebrum kan ikke bruges til udelukkelse af forhøjet ICP.
Anvend kun sedation med kontrolleret ventilation, PaCO2 4,5-5 kPa, MAP ≥ 80 mmHg og P-Na+-koncentration >137 mmol/l, anvend 0,9% NaCl og evt. hyperton NaCl.
Akut bakteriel meningitis (ABM) er en livstruende tilstand. Tilstanden anses for så tidskritisk, at man anbefaler præhospital behandling med antibiotika, særligt ved mistanke om meningokokmeningitis. I den akutte fase af meningitis er forhøjet intrakranielt tryk (ICP) en hyppig årsag til død ved inkarceration og hjerneskade pga. direkte trykskade og iskæmi [1-4].
Forekomsten af ABM i Danmark har en incidens på 1,5-3/100.000/år [5]. Pneumokokker er den hyppigste ætiologi blandt voksne [6] med stigende incidens med stigende alder, mens andre streptokoktyper og Haemophilus influenzae ses sjældnere. Meningokokmeningitis ses få gange årligt i Danmark [5]. ABM ses således yderst sjældent af den enkelte læge.
Behandlingen af voksne med ABM er centreret omkring de infektionsmedicinske afdelinger i samarbejde med bl.a. akutmedicinere, anæstesiologer, neurokirurger, øre-næse-hals-læger, neurologer, neuroradiologer og mikrobiologer. Det kræver en stærk organisation og samarbejde mellem de involverede specialer at sikre rettidig og adækvat behandling af denne akut livstruende tilstand. Retningslinjerne for behandling af ABM fra Dansk Selskab for Infektionsmedicin indeholder en kort gennemgang af forhøjet ICP ved ABM [7]. Et studie fra danske akutmodtagelser viser, at 25% af lægerne ville anvende hypotone væsker ved ABM [8], hvilket kan øge risikoen for forhøjet ICP. I denne artikel ønsker vi at øge fokus på forekomsten af forhøjet ICP og hjælpe med at undgå iatrogen forværring af et potentielt forhøjet ICP ved ABM.
Den intrakranielle skade ved ABM skyldes tilstedeværelsen af levende bakterier såvel som værtsresponset på de bakterielle komponenter. Bakteriebestanddele bindes til og aktiverer receptorer på og inde i immunkompetente celler. Dette medfører produktion af forskellige signalstoffer såsom cytokiner og kemokiner, som medierer yderligere rekruttering af leukocytter og forårsager aktivering af et stort antal signalveje, samt komplement- og koagulationssystemet, hvilket øger det samlede inflammatoriske respons [9]. Inflammationen kan føre til intracerebralt ødem, kardilatation og hydrocefalus, som bidrager til det forhøjede ICP [10]. Således ses vasogent ødem pga. øget permeabilitet af blod-hjerne-barrieren, cytotoksisk ødem med intracellulær ophobning af vand, interstitielt ødem pga. flux af cerebrospinalvæske og hydrocefalus pga. nedsat reabsorption af cerebrospinalvæske. ABM forårsager hyppigt hyponatriæmi. Fald i plasma-natrium (P-Na+)-niveauet, og dermed toniciteten, bidrager til hjerneødemet. Celledød ved ABM skyldes således bl.a. øget ICP med heraf følgende iskæmi eller mekanisk skade, men også mikroblødning, trombose, komplementinduceret poredannelse i cellemembraner, produktion af frie radikaler og apoptose [11]. Antibiotisk behandling er et sine qua non [12]; administration af 10 mg dexametason samtidig med antibiotika, eller senest inden for fire timer, dæmper det systemiske inflammatoriske respons (herunder udvikling af øget ICP) og nedsætter måske af denne grund mortalitet og morbiditet hos patienter med ABM [13].
Referencemetoden for måling af ICP er via et eksternt hjerneventrikeldræn. Hvis patienten ikke har behov for at drænage af cerebrospinalvæske, kan ICP måles via en intrakraniel transducer, der kan placeres epiduralt, subduralt, subaraknoidalt eller (hyppigst) intraparenkymatøst. Et normalt ICP vil vanligvis ligge < 20 mmHg. Ved lumbalpunktur anbefales at måle et åbningstryk med patienten i sideleje som indikator for ICP. Alternativt kan lumbalt tryk også måles kontinuerligt via et lumbalt dræn. Alle monitoreringsmetoder har fordele og ulemper. De væsentligste risici ved invasiv måling af ICP er blødning og infektion.
Viden om ICP ved ABM er stærkt begrænset pga. selektionsbias. ICP kendes kun hos de patienter, hvor der er fundet indikation for at monitorere ICP. Fravalg af monitorering kan skyldes, at patienterne er neurologisk upåvirkede, eller at der er kontraindikationer mod invasive procedurer. Åbningstrykket ved lumbalpunktur som surrogat for ICP er beskrevet i flere studier, men foretages også med stor variation og er formentlig igen påvirket af klinisk mistanke om forhøjet ICP. I adskillige studier har man siden 1965 beskrevet åbningstrykket ved lumbalpunktur. Åbningstrykket varierer, men er ofte forhøjet hos patienter med ABM og er associeret med lavere bevidsthedsniveau vurderet ved Glasgow Coma Scale (GCS) og øget dødelighed [14]. Larsen et al beskrev ICP > 20 mmHg hos 62% og > 40 mmHg hos 26% af patienter ved anlæggelse af ICP-monitorering hos intuberede og bevidsthedspåvirkede patienter behandlet i intensivt regi [6].
Dødsfald forårsaget af inkarceration sker oftest inden for den første uge [1, 15-17], hvilket stemmer overens med, at forhøjet ICP, nedsat GCS og neurologiske udfald ses tidligt i forløbet af ABM. Fald i GCS ses oftest inden for det første indlæggelsesdøgn [6]. Patienter, som indlægges på intensivafdelingen, har meget varierende GCS [4, 6, 18, 19], men tilstanden er i flere tilfælde progredieret til et stadie med påvirkning af pupilreflekser ved ankomst til intensivafdelingen [16, 18].
Observationer af ICP påvirkes af evt. samtidig ICP-reducerende behandling [18], herunder øget sedation, hyperosmolær terapi, ofte hyperton NaCl, hyperventilation, anlæggelse af eksternt hjerneventrikeldræn og i sidste ende dekompressiv kraniektomi [2, 6, 18, 20, 21]. I et svensk prospektivt studie toppede ICP inden for 48 timer efter påbegyndt monitorering og faldt derefter [2]. ICP-forhøjelse ved ABM ses således især tidligt i forløbet og kan udvikle sig rapidt, men falder herefter bl.a. som følge af målrettet ICP-behandling.
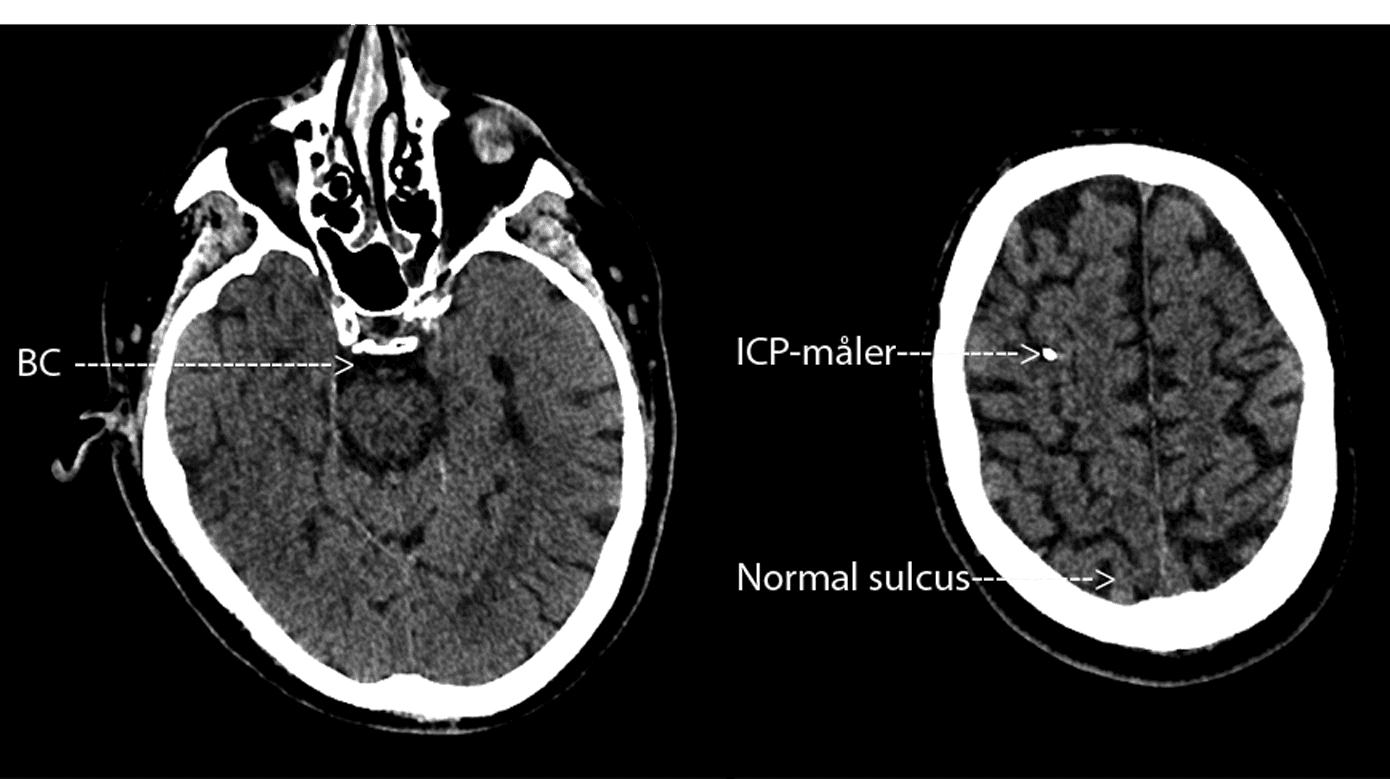
Rutinemæssig CT af cerebrum (CT-C) ved mistanke om ABM er ikke indiceret, da den ofte vil være normal [14, 22]. Derimod er CT-C indiceret ved nedsat bevidsthedsniveau, fokale neurologiske udfald, inklusive kranienervepåvirkning af enhver type, samt kramper [23]. Patienter med ABM visiteret til intensivafdelingen har en højere forekomst af patologisk CT-C med fund af diffust ødem, hydrocefalus og infarkter eller blødninger hos enkelte [1, 2, 16]. Dog er det væsentligt, at i det tidlige forløb af ABM kan ICP være svært forhøjet trods normal CT-C (Figur 1) [1, 6, 24].
Ved en systematisk litteratursøgning på PubMed er der fundet engelsksprogede, observationelle, prospektive [1, 2, 14, 16, 21] og retrospektive [3, 4, 6, 15, 18-20, 25] studier, der indeholder data for ICP ved ABM (Tabel 1). I disse studier synes et højt ICP [20] og et lavt cerebralt perfusionstryk (CPP) beregnet som middelarterietryk (MAP) minus ICP, dvs. CPP = MAP – ICP [6, 20] sammen med svækket vasomotorisk reaktivitet (PRx) som indirekte mål for manglende autoregulation [20] at være prædiktorer for et dårligt outcome. Desuden genfindes velkendte risikofaktorer for dårligt outcome: lav GCS ved indlæggelse [25], fokale neurologiske udfald [19] og pneumokokker som ætiologi sammenlignet med meningokokker [14]. Outcome var ens for patienter med højt og lavt åbningstryk i det største af de inkluderede studier. Åbningstryk blev målt hos 215 ud af 696 patienter [14].
Der foreligger ikke randomiserede studier, hvor man har undersøgt, om behandling af forhøjet ICP vil forbedre outcome efter ABM. I et observationelt studie inkluderedes prospektivt patienter med ABM, og ICP-monitorering blev udført efter en struktureret algoritme [2]. Sammenlignet med en historisk kohorte, der havde modtaget konventionel intensiv terapi, fandtes en relativ risikoreduktion på 68% (mortalitet i interventionsgruppen 10% vs. 30% i kontrolgruppen). Et mindre retrospektivt studie evaluerede effekten af lumbalt dræn. Her var dødeligheden 0% i gruppen med lumbalt dræn, men 15% ved konventionel terapi, hvor fire ud af 26 patienter døde, heraf tre ved inkarceration [16].
Blandt andre grupper med akut hjerneskade, ofte traumer, anvendes ICP-monitorering og behandling hyppigt og er associeret med lavere dødelighed [26]. Den mere sparsomme evidens for ICP-monitorering ved ABM skyldes dels, at patientgruppen er lille sammenlignet med andre grupper med svær akut hjerneskade, dels at gruppen har en højere alder og grad af komorbiditet.
Denne forfattergruppe foreslår, at alle bevidsthedspåvirkede patienter med ABM mistænkes for at have forhøjet ICP. Til sammenligning er ændringer i pupilforhold et sent tegn på intrakranielle komplikationer. Faldende GCS kan således indikere stigende ICP. Jo mere ICP stiger, desto højere bliver risikoen for at udvikle svær ICP-forhøjelse ved ændringer i intrakranielt volumen på selv få milliliter, svarende til at patienten er på den stejle del af tryk-volumen-kurven (Figur 2). Tidlig og korrekt behandling med antibiotika og dexamethason er vigtig samtidig med opmærksomhed på bevidsthedsniveau og på at undgå iatrogen forværring af ICP.
Hos bevidsthedspåvirkede patienter bør der udvises forsigtighed med potentielt ICP-øgende tiltag såsom sedation eller opioidbehandling til procedurer uden samtidig mekanisk ventilation (pga. risiko for hyperkapni og hypoxi) eller indgift af hypotone væsker (Ringer acetat/laktat, glukose, Plasmalyte), som reducerer P-Na+-niveauet i forhold til 0,9 % NaCl (Tabel 2) [27]. Væskebehandlingen bør stile mod at sikre P-Na+-niveauet > 137 mmol/l. Behandling med hyperosmolære væsker til patienter med ABM er dårligt undersøgt [13], men dyrestudier tyder på, at hyperton NaCl ved ABM sænker ICP og måske modificerer det inflammatoriske respons [28]. Hyperton NaCl øger hurtigt og sikkert P-Na+-niveauet (1 mmol/kg øger P-Na+-niveauet med ca. 2 mmol/l), hvilket reducerer ICP. ABM med bevidsthedsændring og P-Na+-niveauet < 137 mmol/l behandles på samme måde som andre tilstande med hyponatriæmi og bevidsthedsændring.
Sedation, intubation og mekanisk ventilation bør overvejes ved GCS ≤ 9, ved konfusion og uro samt ved patienter med pupildifferens, andre fokalneurologiske deficit eller kramper [2]. Anvend neuroprotektiv intubation (Tabel 2). Behovet for ICP-monitorering, herunder evt. overflytning til sygehus, hvor dette kan foretages, bør konfereres med et relevant center tidligt i forløbet pga. risiko for hastig progression i tilstanden. Det europæiske selskab for klinisk mikrobiologi og infektionssygdomme (ESCMID) angiver, at ICP-monitorering ikke kan anbefales som rutine, men kan være livreddende for udvalgte patienter (niveau C) [12]. Endelig bør CT-C foretages på lav tærskel ved klinisk forværring for at udelukke behandlingskrævende intrakranielle komplikationer.
Den nyindlagte patient med ABM bør således observeres tæt med fokus på ændringer i bevidsthed og neurologiske udfald. Ændringer i pupilforhold er et sent tegn, og opmærksomheden på eventuelt forhøjet ICP skal vækkes allerede ved forekomst af konfusion og motorisk uro.
Selv om forhøjet ICP er den mest kendte markør for intrakraniel patofysiologi og prædiktor for død eller sequelae ved svær akut hjerneskade, synes både intracerebral hypoxi og andre intrakranielle homøostaseforstyrrelser at kunne forekomme selv hos patienter med normalt ICP og at være tilsvarende associeret med død og hjerneskade. Få studier har evalueret denne problemstilling hos patienter med ABM [29]. Fremtidige studier bør adressere den kliniske gevinst af såvel monitorering og behandling af forhøjet ICP som evt. supplerende overvågning af intrakraniel homøostase. Samtidig ville sikker noninvasiv ICP-måling være en fordel, men der mangler fortsat erfaring og evidens på området [30].
ABM er en sjælden og tidskritisk tilstand med høj risiko for død og permanent hjerneskade. Den bevidsthedspåvirkede patient med ABM har med stor sandsynlighed forhøjet intrakranielt tryk, som det er afgørende at være opmærksom på og undgå at forværre.
Korrespondance Christian Overgaard-Steensen. E-mail: christian.overgaard.steensen@regionh.dk
Antaget 24. oktober 2023
Publiceret på ugeskriftet.dk 18. december 2023
Interessekonflikter ingen. Forfatternes ICMJE-formularer er tilgængelige sammen med artiklen på ugeskriftet.dk
Referencer findes i artiklen publiceret på ugeskriftet.dk
Artikelreference Ugeskr Læger 2023;185:V06230363
Christine Lodberg Hvas, Åse Bengård Andersen, Kirsten Møller, Klaus Hansen, Frantz Rom Poulsen & Christian Overgaard-Steensen
Ugeskr Læger 2023;185:V06230363
Acute bacterial meningitis (ABM) is associated with increased intracranial pressure (ICP) caused by bacterial invasion and the host response to infection. Antibiotic therapy is a sine qua non, and adjunct dexamethasone decreases mortality. The ICP increase may have a rapid course and death due to herniation is most often seen within the first week. Evidence regarding treatment of increased ICP in ABM is limited; this review summarises observational studies which point towards reduced mortality by applying a structured approach towards normalization of ICP in ABM.