High-resolution anoskopi kan diagnosticere forstadier til analcancer

Helle Kiellberg Larsen1, Merete Hædersdal1 & Susanne Krüger Kjær2, 3
Hovedbudskaber
Analcancer er en relativt sjælden cancer med et estimeret antal nye tilfælde på 50.865 og 19.293 dødsfald på verdensplan i 2020 [1]. I Danmark diagnosticeres der årligt omkring 150 tilfælde af analcancer, hvoraf to tredjedele er hos kvinder [2]. Incidensen af analcancer i Danmark og flere andre vestlige lande har imidlertid været stigende over de seneste årtier for både kvinder og mænd [3, 4]. Hovedparten af analcancere er planocellulære karcinomer (PCC) [3, 4]. Anal-PCC forudgås af forstadier, anal-high-grade squamous intraepithelial lesions (anal-HSIL), der inkluderer både moderat dysplasi (anal intraepitelial neoplasi (AIN2)) og svær dysplasi (AIN3) samt PCC in situ [5]. Mere end 80% af anal-HSIL og anal-PCC forårsages af højrisiko (hr)-HPV-typer, hvoraf HPV16 er den mest karcinogene [6]. Et nyere dansk registerstudie viste, at i perioden 1998-2018 blev gennemsnitlig kun en tredjedel af patienter med analcancer diagnosticeret i det tidligste stadie uden spredning [3]. Den primære behandlingsform af analcancer er kemo-stråle-behandling [7]. High-resolution anoskopi (HRA) er en metode til at undersøge for anal-HSIL, analogt til kolposkopi for cervikal dysplasi hos kvinder [8].
Formålet med denne statusartikel er:
1) at gøre opmærksom på anvendelsen af HRA
2) at gennemgå, hvilke grupper der er i øget risiko for analcancer
3) at diskutere HRA’s rolle som potentiel screeningsmetode mod analcancer hos risikogrupper.
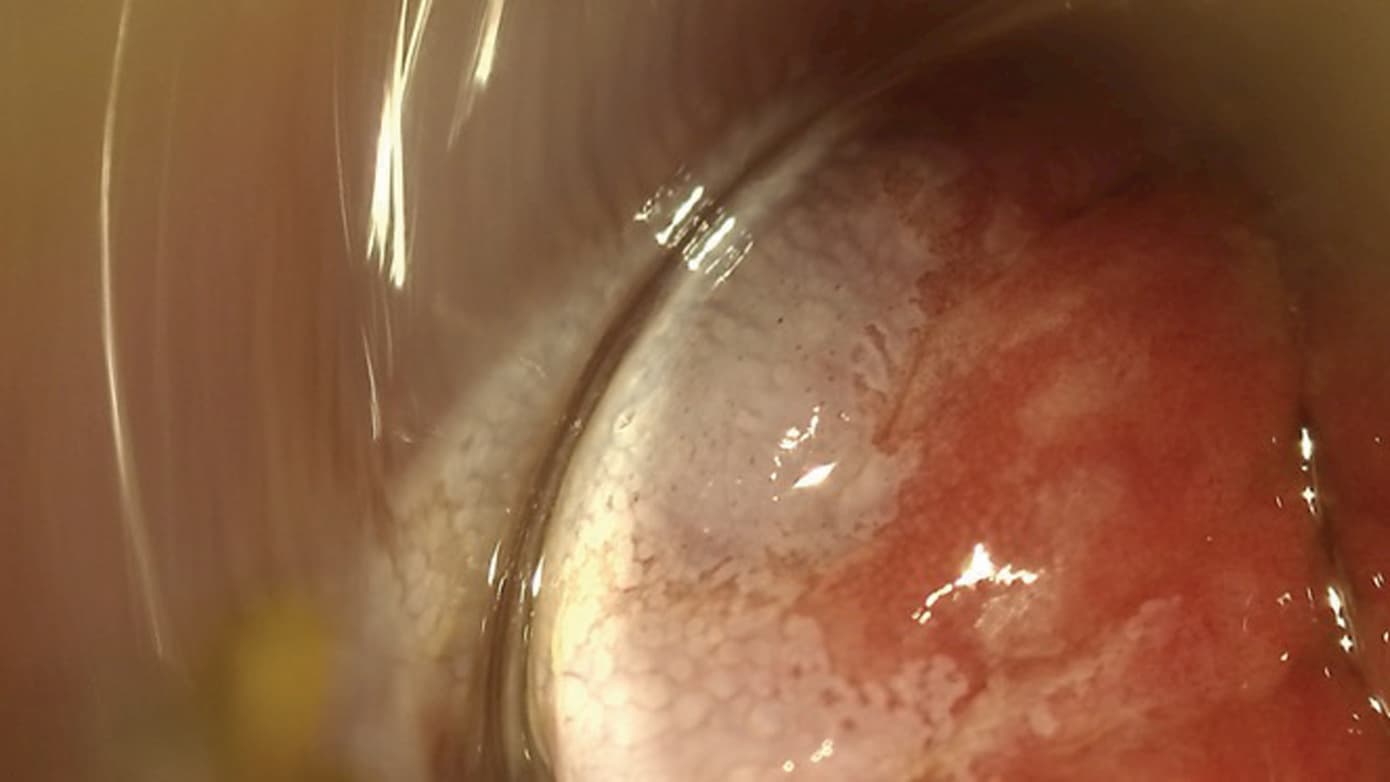
De fleste tilfælde af HPV-relaterede forandringer i analkanalen optræder i transformationszonen mellem cylinderepitelet i rectum og pladeepitelet i analkanalen, herunder anal-HSIL. De fleste tilfælde af anal-HSIL er ikke synlige for det blotte øje og kan ikke palperes ved anorektaleksploration [9]. For at synliggøre områder med HSIL appliceres 3-5% eddike i analkanalen i to minutter. Den normale slimhinde vil være transparent. Ved både low-grade SIL (LSIL) og HSIL vil slimhinden farves hvid, og især ved HSIL ses varierende karforandringer som f.eks. punktuation og mosaicisme, der skal foranledige biopsi (Figur 1A og B). HRA kan suppleres med Lugols opløsning, som er en kaliumiodidopløsning [10] (se Figur 1C og D). Det er væsentligt, at hele transformationszonen visualiseres, og undersøgelsen udfordres bl.a. af folder, slim, afføring og hæmorider [8].
HRA indledes med anorektal eksploration, også af perianalområdet, med henblik på at opdage eventuelle tumorer, herunder submukøse, med samtidig applikation af lidocaingel 2% blandet med eksplorationsgel, der mindsker svie ved den efterfølgende applikation af eddike [10, 11].
HRA kræver et ekstensivt træningsforløb og har en lang læringskurve [12]. Kurser i HRA tilbydes af International Anal Neoplasia Society, hvis medlemmer er bredt fagligt repræsenteret [8].
I nedenstående afsnit vil grupper af patienter med øget risiko for anal-HPV, anal-HSIL og analcancer blive gennemgået. Disse grupper består overordnet af immunsupprimerede patienter og patienter med tidligere HPV-relaterede lidelser.
Hiv-infektion og mænd, der har sex med mænd
Hiv-inficerede mænd, der har sex med mænd (MSM), er den gruppe, der er fundet at have den højeste risiko for anal-HSIL og analcancer, og især i en alder af ≥ 45 år [13]. En metaanalyse fandt således incidensrater (IR) for analcancer på 85 og 20 pr. 100.000 hos henholdsvis hiv-inficerede og hiv-uinficerede MSM [13]. Tilsvarende fandtes IR af analcancer på 32 og 22 pr. 100.000 hos henholdsvis hiv-inficerede mænd, der har sex med kvinder (MSK), og hiv-inficerede kvinder [13]. Til sammenligning er aldersstandardiserede IR for analcancer hos den generelle befolkning i Danmark fundet at være 0,91 og 2,21 pr. 100.000 for henholdsvis mænd og kvinder [3].
En nylig metaanalyse i Lancet HIV viste en højere prævalens af anal-HPV (hrHPV: 74,3% versus 41,2%; HPV16: 28,5% versus 13,7%) og anal-HSIL (22,4% versus 11,3%) hos hiv-inficerede MSM sammenlignet med hiv-uinficerede MSM, og hiv-infektion fandtes at være en stærk risikofaktor for anal-HSIL [14]. Tilsvarende fandtes en øget prævalens af anal-HPV hos hiv-inficerede MSK sammenlignet med hiv-uinficerede MSK (hrHPV: 26,9% versus 6,9%; HPV16: 8,7% versus 1,8%). En tilsvarende metaanalyse for hiv-inficerede kvinder fandt en samlet prævalens af anal-HSIL på 6% [15]. I samme studie fandt man, at prævalensen af cervikal HPV16, men ikke af anal-HPV16, faldt med stigende alder hos hiv-inficerede kvinder [15]. Et senere tværsnitsstudie, der inkluderede 256 hiv-inficerede kvinder, viste en prævalens af anal-HSIL på 27%, samt at CD4-tal < 200/mm3 og analt receptivt samleje var signifikante risikofaktorer [16].
Organtransplanterede patienter
Registerbaserede studier har vist en øget risiko for HPV-relaterede anogenitale cancere, herunder analcancer blandt organtransplanterede patienter (OTP), sammenlignet med ikketransplanterede kontroller [17, 18]. I en metaanalyse fandt man en IR af analcancer hos OTP på 13 pr. 100.000. Denne IR steg med stigende alder, men antal år efter transplantation var en bedre prædiktor for risiko, med IR på 24,5 og 49,6 pr. 100.000 for henholdsvis mænd og kvinder ≥ 10 år efter transplantation [13]. I et dansk studie af 247 nyretransplanterede patienter (NTP) og 248 raske kontroller fandt man øget risiko for anal-HSIL hos NTP sammenlignet med kontroller både for mænd (6,5% versus 0,8%, justeret oddsratio (OR) = 11,21; 95% konfidens-interval (KI): 1,46-291,17) og for kvinder (15,4% versus 4,0%, justeret OR = 6,41; 95% KI: 2,14-24,10) [19]. Anal-HSIL blev udelukkende påvist hos NTP og kontroller, der var hrHPV-positive, og blandt HPV16-positive NTP var prævalensen af anal-HSIL 53,8% (7/13), mens den var 29,4% (5/17) hos kontroller (p = 0,26). For andre hrHPV-typer end HPV16 var de tilsvarende tal 29,9% (20/67) hos NTP og 2,2% (1/46) hos kontroller (p < 0,001) [19]. Risikofaktorer var tidligere anogenitale kondylomer, receptivt analt samleje og anal-hrHPV-infektion [19].
Autoimmune lidelser
I et tidligere, dansk registerbaseret studie af patienter med autoimmune lidelser, der typisk kræver immunsuppressiv behandling, fandt man en samlet øget standardiseret incidensratio (SIR) af analcancer på 1,3 pr. 100.000, der varierede i forhold til type af autoimmun lidelse og var højest for Wegeners granulomatose, polyarteritis nodosa, psoriasis og morbus Crohn (med SIR varierende mellem 3,1 og 12,4 pr. 100.000) [18]. I en metaanalyse fandt man også forhøjede IR af analcancer hos systemisk lupus erythematosus samt ulcerativ colitis (henholdsvis ti og seks pr. 100.000) [13].
Kvinder med tidligere genital dysplasi eller cancer
Sand et al [20] har tidligere i en dansk registerundersøgelse rapporteret en øget risiko for anal-, vulva- og vaginalcancer hos kvinder tidligere diagnosticeret med cervikal intraepitelial neoplasi grad 2 (CIN2) og CIN3. En metaanalyse viste øget risiko for analcancer hos kvinder med tidligere CIN3 og cervixcancer (IR på henholdsvis seks og ni pr. 100.000), tidligere vulva-intraepitelial neoplasi grad 3 og vulvacancer (IR på henholdsvis 42 og 48 pr. 100.000) samt tidligere vaginal intraepitelial neoplasi grad 3 og vaginalcancer (IR på henholdsvis 19 og ti pr. 100.000) [13].
Tidligere anogenitale kondylomer
Det er også tidligere rapporteret i et dansk studie, at patienter diagnosticeret med anogenitale kondylomer havde en øget risiko for udvikling af HPV-relaterede cancerformer med SIR for analcancer på 21,5 og 7,8 pr. 100.000 for henholdsvis mænd og kvinder, der forblev signifikant forhøjede ≥ 10 år efter kondylomdiagnosen [21]. SIR for cervixcancer (1,5 pr. 100.000) var mindre end for analcancer, sandsynligvis pga. det eksisterende danske screeningsprogram mod cervixcancer [21]. En metaanalyse af 1.733 patienter med anale kondylomer viste, at 24% af immunsupprimerede patienter og 11,8% af immunkompetente patienter fik påvist HSIL i kondylomerne, hvilket formentlig skyldtes samtidig infektion med hrHPV-typer [22].
Anal-HSIL kan behandles med ablative metoder som elektrokaustik, CO2-laser eller infrarød koagulation, endvidere med kirurgisk excision samt topikalt med imiquimod, 5-fluoruracil, cidofovir eller trichloreddikesyre, afhængig af antal og størrelse af forandringerne [23]. Ablativ behandling er fundet at være topikal behandling overlegen, men ved alle behandlinger ses recidivrater på 50% eller mere [23, 24].
Et stort amerikansk multicenterstudie, The ANCHOR Study, inkluderende 4.446 hiv-inficerede patienter på 35 år eller ældre med anal-HSIL, har nu endelig vist, at behandling af anal-HSIL ved udførelse af HRA nedsætter risikoen for analcancer sammenlignet med observation uden behandling (ni tilfælde af analcancer i opfølgningsperioden i behandlingsgruppen versus 21 tilfælde i observationsgruppen og således 57% reduktion) [25]. Af deltagerne var 80,5% mænd, hvoraf 77% var MSM [25].
En dansk, populationsbaseret registerundersøgelse fandt blandt 1.237 personer med AIN3 en overordnet femårsrisiko for progression til analcancer på 3,4% [26]. Risikoen forblev øget i mere end ti år, hvilket indikerer et behov for længere opfølgning [26]. Til sammenligning var femårsrisikoen blandt hiv-inficerede individer 14,1% [26]. I ANCHOR-studiet fandtes en kumulativ incidens af analcancer ved 48 måneder på 0,9% i behandlingsgruppen versus 1,8% i observationsgruppen [25]. Progressionsraten fra anal-HSIL til analcancer fandtes øget ved udbredelse af HSIL på 50% eller mere af analkanalen eller perianalområdet [25].
Metoder til screening mod anal-HSIL er adopteret fra cervixcancerscreening [27]. De centre, der udfører screening mod analcancer, har baseret denne på ekspertudsagn og tilgængelige ressourcer, se Figur 2 [27]. Mest udbredt er screening med analcytologi, der er begrænset af suboptimal sensitivitet og specificitet [27]. Ved abnormt fund henvises til HRA (se Figur 2). Sensitiviteten af analcytologi øges ved samtidig test for hrHPV, men den høje prævalens af anal-hrHPV hos især hiv-inficerede MSM nedsætter specificiteten [27, 28]. Analcytologi og anal-HPV-test anbefales kun udført, såfremt der kan tilbydes opfølgende HRA [27].
Primær forebyggelse af analcancer inkluderer kønsneutral HPV-vaccination og helst før seksuel debut (Figur 2) [27]. Sekundær analcancerforebyggelse involverer som anført screening med analcytologi med eller uden HPV-test og henvisning til HRA ved abnorme fund og behandling af anal-HSIL (Figur 2) [27]. Sekundær forebyggelse involverer også catch-up-HPV-vaccinationsprogrammer, herunder af unge MSM op til 26 år, der aktuelt ikke tilbydes i Danmark [29]. Ikke alle anal-HSIL udvikler sig til cancer, og ligesom for cervixdysplasi vil en vis procentdel regrediere spontant [30]. I et studie af 617 MSM, heraf 37% hiv-inficerede, fandt man blandt dem, som fik påvist anal-HSIL, regression af HSIL-forandringerne hos 22% i løbet af opfølgningsperioden, og faktorer associeret med regression var alder < 45 år, øget hyppighed af AIN2 i forhold til AIN3, mindre læsioner og ikkepersisterende infektion med HPV16 [30]. Forskning pågår med henblik på identifikation af biomarkører, der kan bruges i en differentieret screening for anal-HSIL, så man undgår overbehandling og kan udnytte ressourcerne mest hensigtsmæssigt [27].
Tertiær forebyggelse involverer anorektal eksploration for at opdage analcancer i tidligt stadie [11, 27] (Figur 2).
ANCHOR-studiet har demonstreret, at behandling af anal-HSIL ved udførelse af HRA nedsætter risiko for udvikling af analcancer. I Danmark er indført primær profylakse af cervikal og analcancer for piger og for analcancer for drenge i det danske børnevaccinationsprogram (HPV-vaccination). En medicinsk teknologivurdering bør foretages med diskussion af værdien af sekundær profylakse for øje, herunder prioritering af risikogrupper, screening med analcytologi og/eller hrHPV, samt hvilke specialer der potentielt skal involveres i uddannelse af HRA-klinikere. Relevansen af eventuel tertiær forebyggelse bør også inkluderes i en sådan vurdering.
Korrespondance Helle Kiellberg Larsen. E-mail: hellekl@dadlnet.dk
Antaget 11. januar 2023
Publiceret på ugeskriftet.dk 27. februar 2023
Interessekonflikter Der er anført potentielle interessekonflikter. Forfatternes ICMJE-formularer er tilgængelige sammen med artiklen på ugeskriftet.dk
Artikelreference Ugeskr Læger 2023;185:V10220616
Helle Kiellberg Larsen, Merete Hædersdal & Susanne Krüger Kjær
Ugeskr Læger 2023;185:V10220616
Anal cancer risk is increased in certain risk groups including people living with HIV (PLWH), especially in men who have sex with men, but also in organ transplant recipients and women with a history of cervical or vulva dysplasia or cancer. High-resolution anoscopy (HRA) is a tool to diagnose anal high-grade squamous intraepithelial lesions (HSIL), and HRA-guided treatment of anal HSIL has been shown to reduce the risk of anal cancer in PLWH. The purpose of this review is to increase the awareness of HRA but also of tertiary prevention by digital anal rectal examination.