HPV-vaccination til immunsupprimerede kvinder

Dina Overgaard Eriksen1, 2, Marianne Pape3, Lone Kjeld Petersen4, 5, Carsten Schade Larsen2, 6, Bjarne Kuno Møller2, 7 & Anne Hammer1, 2
Hovedbudskaber
Immunkompromitterede patienter er i øget risiko for en række infektioner, herunder smitte med humant papillomvirus (HPV) og for udvikling af HPV-relateret sygdom som eksempelvis kondylomer, anogenital dysplasi og cancer. Det skyldes bl.a., at bekæmpelse af en HPV-infektion kræver et lokalt cellulært immunrespons med aktivering af T-cellerne [1]. HPV er med en livstidsprævalens på op til 80% det hyppigste seksuelt overførte virus [2], og hos immunkompetente er de fleste HPV-infektioner forbigående og bliver ikkedetekterbare uden behandling i løbet af 1-2 år.
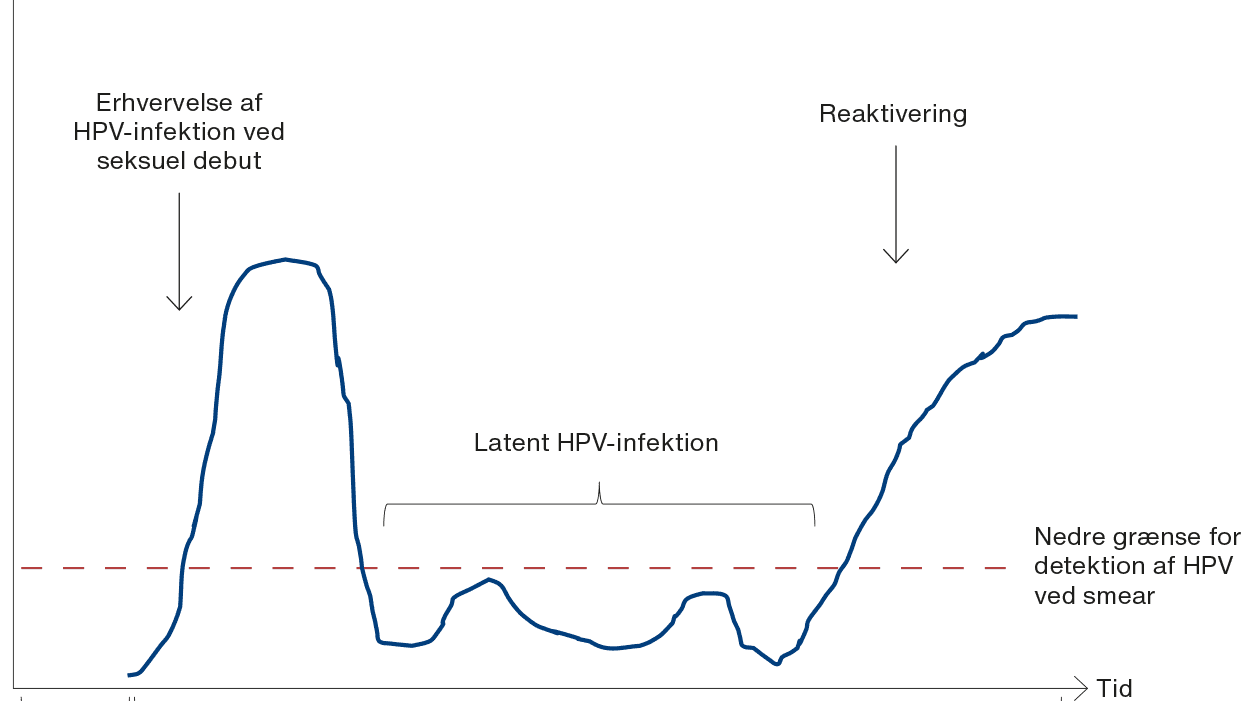
HPV-vaccination tilbydes i Danmark med Gardasil 9 (HPV-type 6, 11, 16, 18, 31, 33, 45, 52 og 58) til piger og drenge under 15 år i et todosisregime som led i det danske børnevaccinationsprogram [3]. Personer, der er 15 år eller derover, anbefales tre doser [2]. Det anbefales, at HPV-vaccinen gives før seksuel debut (Figur 1), idet studier har vist, at vaccinen yder bedst beskyttelse mod behandlingskrævende cervixdysplasi og -cancer inden potentiel smitte [4], mens der ikke er dokumenteret effekt af HPV-vaccination hos kvinder over 20 år [5]. Der er ikke evidens for, at HPV-vaccination kan forhindre en HPV-infektion, der er til stede på vaccinationstidspunktet som en aktiv eller latent HPV-infektion, i at progrediere til dysplasi og cancer. HPV-vaccinen er en rekombinant, ikkelevende vaccine, der ikke forårsager sygdom hos immunkompromitterede patienter [6]. Det er derfor ikke kontraindiceret at vaccinere denne patientgruppe. Immunkompromitterede patienter har ofte et insufficient immunologisk respons på vaccination, afhængig af grundsygdom og det immunmodulerede regime [7]. Derfor kan den beskyttende effekt af vaccinen være reduceret.
Alle vacciner tilsættes adjuvans for at forbedre immunreaktionen. Der er blevet anvendt forskellige typer adjuvans i de forskellige HPV-vacciner, der har været på markedet gennem årene, og man kan forestille sig, at immunsuppressionens betydning for immunogenicitet af vaccinerne afhænger af den anvendte adjuvans, men der er ikke lavet studier på dette for immunsupprimerede patienter. Vaccinen genererer primært et humoralt respons, men der sker formentlig også en aktivering af immunsystemets T-celler [6].
Vi ønsker med denne artikel at gennemgå litteraturen med henblik på at beskrive HPV-vaccinens immunogenicitet og beskyttelse mod udvikling af behandlingskrævende cervixdysplasi og -cancer hos kvinder, som er immunsupprimerede pga. autoimmune sygdomme, organtransplantation eller hiv-infektion.
Patienter med autoimmune sygdomme har både en intrinsic og en extrinsic påvirkning af immunsystemet, intrinsic i form af bl.a. autoantistoffer og komplementaktivering og extrinsic i form af immunsupprimerende behandling.
Der er sparsom litteratur om kvinder med autoimmune sygdomme og risiko for HPV-relateret sygdom, og generelt er det bedst undersøgt for den autoimmune sygdom systemisk lupus erythematosus (SLE). Disse patienter er i øget risiko for persisterende HPV-infektioner og udvikling af HPV-relaterede præmaligne og maligne sygdomme [8, 9]. Kvinder med reumatoid artritis (RA) og SLE har 50% øget risiko for cervixcancer og behandlingskrævende cervixdysplasi sammenlignet med den generelle befolkning [10]. For patienter med inflammatorisk tarmsygdom (IBD) ses modsatrettet evidens [10, 11].
Der er studier på den tovalente (HPV 16/18) og firevalente (HPV 6/11/16/18) HPV-vaccines immunogenicitet hos piger og kvinder med SLE, RA og IBD [8, 12]. Der er alene set på antistofniveau som proxy for et adækvat T- og B-cellerespons, men det vides ikke med sikkerhed, hvor højt antistofresponset skal være, for at der er maksimal effekt. Studierne viser lavere antistoftitre, samt at færre serokonverterer sammenlignet med aldersmatchede raske kontrolpersoner [8]. Der ses endvidere et hurtigere fald i antistoftiter hos patienter med SLE over tid. Ældre alder på vaccinationstidspunktet synes ligesom for immunkompetente personer at resultere i lavere serokonvertering, lavere antistoftitre og højere risiko for seroreversion i løbet af fem år hos patienter med SLE [12].
Det er uvist, om fald i antistoftiter øger risikoen for behandlingskrævende cervixdysplasi hos denne patientkategori, ligesom der ikke er studier på, om en boostervaccination med fjerde vaccinedosis vil kunne stabilisere antistofniveauet. Trods et lavere immunologisk respons hos denne gruppe patienter formodes det, at selv lavere antistoftitre yder en vis beskyttelse mod HPV-relateret sygdom hos kvinder, der på vaccinationstidspunktet er HPV-naive. Der er ikke fundet evidens for vaccineudløst forværring eller opblussen i autoimmun sygdom efter HPV-vaccination ved SLE og IBD [13]. Dette er ikke undersøgt for RA [8, 12, 13].
På baggrund af ovenstående anbefaler European Alliance of Associations for Rheumatology (EULAR) HPV-vaccination til patienter med SLE og RA på lige fod med den generelle befolkning [14]. I mange lande anbefales HPV-vaccination op til 26 år [15], selvom der ikke foreligger direkte evidens for, at catch-up-vaccination nedsætter risikoen for behandlingskrævende cervixdysplasi hos kvinder med autoimmune sygdomme [16]. HPV-vaccination foretages optimalt på diagnosetidspunktet for autoimmun sygdom eller minimum to uger før opstart af immunmodulerende behandling [17]. HPV-vaccination kan foretages under samtidig immunsupprimerende behandling, men kan resultere i et dårligere immunologisk respons [17].
Hos patienter, der undergår organtransplantation, er immunsupprimerende behandling nødvendig for at hæmme organafstødningen.
Studier har vist, at organtransplanterede patienter har en betydeligt øget risiko for HPV-relateret anogenital dysplasi og cancer. Denne gruppe er også i højere risiko for at få HPV genpåvist efter opstart af immunsupprimerende behandling, hvilket formentlig skyldes en reaktivering af latent HPV-infektion, dvs. en genpåvisning af en infektion, kvinden har pådraget sig flere år tidligere [18]. Eksempelvis har et nyligt dansk studie vist, at nyretransplanterede kvinder har næsten tre gange øget øjeblikkelig risiko for cervixcancer, 31 gange øget øjeblikkelig risiko for vulvacancer og ti gange øget øjeblikkelig risiko for analcancer sammenlignet med raske [19].
Der er sparsom litteratur om immunogenicitet ved HPV-vaccination af denne patientgruppe [20]. Der foreligger ingen randomiserede studier, og de fleste tilgængelige studier er på små, heterogene studiepopulationer. Nogle studier viser lavere serokonverteringsrater for organtransplanterede [21], mens andre viser serokonverteringsrater nogenlunde på niveau med raske [22]. Der er ikke evidens for en øget risiko for organafstødning efter vaccination med den firevalente HPV-vaccine [22].
Der foreligger for nuværende ingen direkte evidens for, at HPV-vaccination nedsætter risikoen for behandlingskrævende cervixdysplasi og -cancer hos organtransplanterede kvinder. Pga. den øgede risiko for HPV-relateret sygdom og cancer hos organtransplanterede anbefaler nationale og internationale retningslinjer dog HPV-vaccination til kvinder forud for organtransplantation og opstart af immunsupprimerende behandling [7, 23, 24]. Den øvre aldersgrænse for anbefaling af HPV-vaccination er arbitrær og varierer fra 26 til 30 år og op til 45 år for kvinder, der er i særlig øget risiko for at pådrage sig nye HPV-infektioner. Det er vigtigt, at immunsystemet vurderes robust for at kunne opnå et tilfredsstillende antistofrespons og dermed maksimal effekt af vaccinen [7, 23, 24], samt at kvinderne informeres om, at vaccinerne er profylaktiske og ikke beskytter mod infektioner, en kvinde allerede har pådraget sig tidligere i livet [16]. Kan HPV-vaccination af tidsmæssige årsager ikke foretages inden transplantation, anbefales at afvente minimum tre til seks måneder efter transplantation, når immunsuppression nærmer sig vedligeholdelsesbehandling [23].
Patienter med hiv-infektion har en højere risiko for infektion med multiple HPV-typer, persisterende HPV-infektion og HPV-associeret sygdom, inkl. cancer [25, 26]. Risikoen stiger med faldende CD4+-T-celletal. Kvinder med hiv har øget risiko for svær cervixdysplasi samt en 2 til 22 gange øget risiko for cervixcancer sammenlignet med kvinder uden hiv [26]. Ligeledes har kvinder med hiv næsten syv gange højere risiko for analcancer sammenlignet med kvinder uden hiv [26].
I et systematisk review og metaanalyse af Zhan et al [25] fandt man, at de tilgængelige HPV-vacciner er sikre og effektive hos hiv-inficerede, med serokonvertering hos 94-98% for HPV 6/11/16, hvilket svarer nogenlunde til niveauet hos raske, hvor det også er velkendt, at antistoftiter falder over tid. Specielt er det kendt, at et rapidt fald især ses for anti-HPV 18. Dog serokonverterer signifikant færre for HPV 18 (90%) sammenlignet med raske kontrolpersoner (96%). Der mangler evidens for, om en fjerde boosterdosis kan forsinke faldet i antistof, hvorfor dette ikke anbefales på nuværende tidspunkt [27].
Ligesom for organtransplanterede kvinder foreligger der ikke evidens for, at HPV-vaccination reducerer forekomsten af behandlingskrævende cervixdysplasi og -cancer hos kvinder med hiv. Studier har vist, at kvinder med hiv har en højere risiko for reaktivering af en latent HPV-infektion [28], men som hos immunkompetente kvinder er der ingen evidens for, at HPV-vaccination kan forhindre videreudvikling af behandlingskrævende cervixdysplasi og -cancer. Pga. den øgede risiko for HPV-relateret sygdom, og fordi HPV-vaccination er vist at være sikker i denne patientgruppe, anbefaler European AIDS Clinical Society, at alle kvinder med hiv i alderen 9-45 år vaccineres med tre doser HPV-vaccine. Det anbefales, at patienterne har CD4+-T-celletal > 200/ml samt umålelig hiv-RNA på vaccinationstidspunktet for at sikre bedst muligt vaccinerespons [29]. Centers for Disease Control and Prevention anbefaler HPV-vaccination til kvinder med hiv op til 26 år uafhængigt af CD4+-T-celletal, og kun efter individuel risikovurdering kan kvinder op til 45 år anbefales HPV-vaccination, såfremt de har CD4+-T-celletal > 200/ml [30].
Hos immunkompetente kvinder er HPV-vaccination før seksuel debut effektivt til forebyggelse af behandlingskrævende cervixdysplasi og -cancer. For immunsupprimerede kvinder, der har en betydeligt højere risiko for behandlingskrævende cervixdysplasi og -cancer, har HPV-vaccination vist sig at være sikker og generere et sufficient antistofrespons. På trods af at der ikke foreligger evidens for HPV-vaccinens effekt til at nedsætte risikoen for udvikling af behandlingskrævende cervixdysplasi og -cancer hos immunsupprimerede kvinder, anbefaler flere nationale og internationale videnskabelige selskaber rutinemæssig HPV-vaccination. Ud fra eksisterende litteratur på området er det ikke muligt at konkludere, om HPV-vaccination af immunsupprimerede kvinder effektivt forebygger behandlingskrævende cervixdysplasi og -cancer. Der er derfor behov for yderligere forskning på området.
Korrespondance Dina Overgaard Eriksen. E-mail: dinaoeriksen@clin.au.dk
Antaget 16. maj 2023
Publiceret på ugeskriftet.dk 10. juli 2023
Interessekonflikter Der er anført potentielle interessekonflikter. Forfatternes ICMJE-formularer er tilgængelige sammen med artiklen på ugeskriftet.dk
Referencer findes i artiklen publiceret på ugeskriftet.dk
Artikelreference Ugeskr Læger 2023;185:V01230005
Dina Overgaard Eriksen, Marianne Pape, Lone Kjeld Petersen, Carsten Schade Larsen, Bjarne Kuno Møller & Anne Hammer
Ugeskr Læger 2023;185:V01230005
Immunocompromised women are at increased risk of having HPV detected and developing HPV-related diseases such as genital warts, anogenital dysplasia, and cancer. This review aims to summarize the current literature regarding the immunogenicity of the HPV vaccine in immunocompromised women and to discuss whether HPV vaccination may be able to reduce the risk of cervical dysplasia and cancer. HPV vaccination induces an immune response in these women; however, it is unknown whether vaccination is effective in reducing the risk of cervical dysplasia and cancer. Further research is needed.