Importeret leishmaniasis

Mike Zangenberg1, 2, Marie Helleberg3, 4, Christen Rune Stensvold1 & Henrik Vedel Nielsen1
De fleste tilfælde af leishmaniasis er importeret fra Sydeuropa og Sydamerika.
Immunsvækkede patienter er i risiko for alvorlige manifestationer, og infektionen kan være latent og først foranledige sygdom, når immunsystemet bliver svækket.
Ved mistanke sendes biopsi til PCR-undersøgelse.
Leishmaniasis er en vektorbåren sygdom forårsaget af parasitten Leishmania. Denne overføres til mennesker af sandfluer og findes endemisk i troperne og subtroperne, herunder Sydeuropa [1]. Mennesker smittes i forbindelse med sandfluens bid [2]. Leishmania-art og værtens immunkompetence er afgørende for, om infektionen bliver symptomatisk, og om der udvikles kutan, mukokutan eller visceral leishmaniasis. Traditionelt er sygdommen opdelt i Old World-leishmaniasis, som forekommer i Asien, Mellemøsten, Afrika (specielt nord og øst) og Sydeuropa, og i New World-leishmaniasis, som findes i Central- og Sydamerika (Figur 1) [3].
I Old World er de hyppigste arter L. major, L. tropica og L. aethiopica samt L. donovani kompleks (som omfatter L. donovani og L. infantum) [3]. I New World er de hyppigste arter L. mexicana kompleks (som omfatter L. mexicana, L. amazonensis og L. venezuelensis) samt arterne i Viannia-gruppen, såsom L. braziliensis, L. guyanensis, L. panamensis og L. peruviana. L. infantum findes desuden i New World [3].
På verdensplan er der cirka en million nye tilfælde af kutan leishmaniasis om året og omkring 100.000 tilfælde af visceral leishmaniasis [2].
Der er relativt få tilfælde af leishmaniasis i Danmark. Sandfluer findes ikke i Danmark, og der er derfor ikke risiko for indirekte smitte fra person til person i Danmark, ej heller fra dyr til mennesker. På grund af den lave forekomst i Danmark er der begrænset viden og bevidsthed om sygdommen, hvilket kan forsinke diagnostik og behandling og derved potentielt forværre sygdommen. Med denne artikel ønsker vi at sætte fokus på sygdommen, at gøre opmærksom på, hvornår man skal fatte mistanke om infektionen, samt at kort beskrive behandlingen.
I Landspatientregisteret (LPR) blev der registreret 169 personer med en ICD-10-diagnose for leishmaniasis i perioden 2011-2022. Tilsvarende antal er fundet i Sverige [4]. Som publiceret for nylig i EPI-NYT, blev der hos Statens Serum Institut (SSI) i samme periode foretaget i alt 1.941 test for leishmaniasis (590 PCR-test og 1.351 antistoftest) fordelt på 1.526 patienter [5]. Man fandt en positiv rate på 17% for PCR-test (85/494) og 1,4% (17/1.254) for antistoftest. De positive test fra SSI fordelte sig på 91 personer med en medianalder på 41 år (spredning: 1-81 år), 34% (31/90) var kvinder, og prøverne var jævnt fordelt over hele landet.
Forskellen i antallet af patienter med en diagnosekode i LPR og antallet med en positiv, mikrobiologisk test skyldes formentlig, at en del patienter var diagnosticeret alene på baggrund af en histologisk undersøgelse eller ingen af metoderne, hvilket øger muligheden for fejldiagnoser.
Ud af de 85 patiententer med positiv PCR-test fandt man 70 med formodet kutan leishmaniasis (82%), ni med formodet visceral leishmaniasis (11%), en med formodet mukokutan leishmaniasis (1%) og fem uvisse (6%). Alle antistoftest på personer med formodet visceral leishmaniasis var enten »positiv« (6/7) eller »gråzone« (1/7), jf. nedenstående afsnit om antistoftest.
Man bør have mistanke om leishmaniasis hos en patient med relevant klinik og rejseanamnese. Sygdommen har endemisk forekomst i Sydeuropa, og der har været adskillige importerede tilfælde fra Spanien og Italien. Det er værd at bemærke, at man ikke nødvendigvis mærker eller ser, at man bliver bidt af en sandflue.
Kutan leishmaniasis
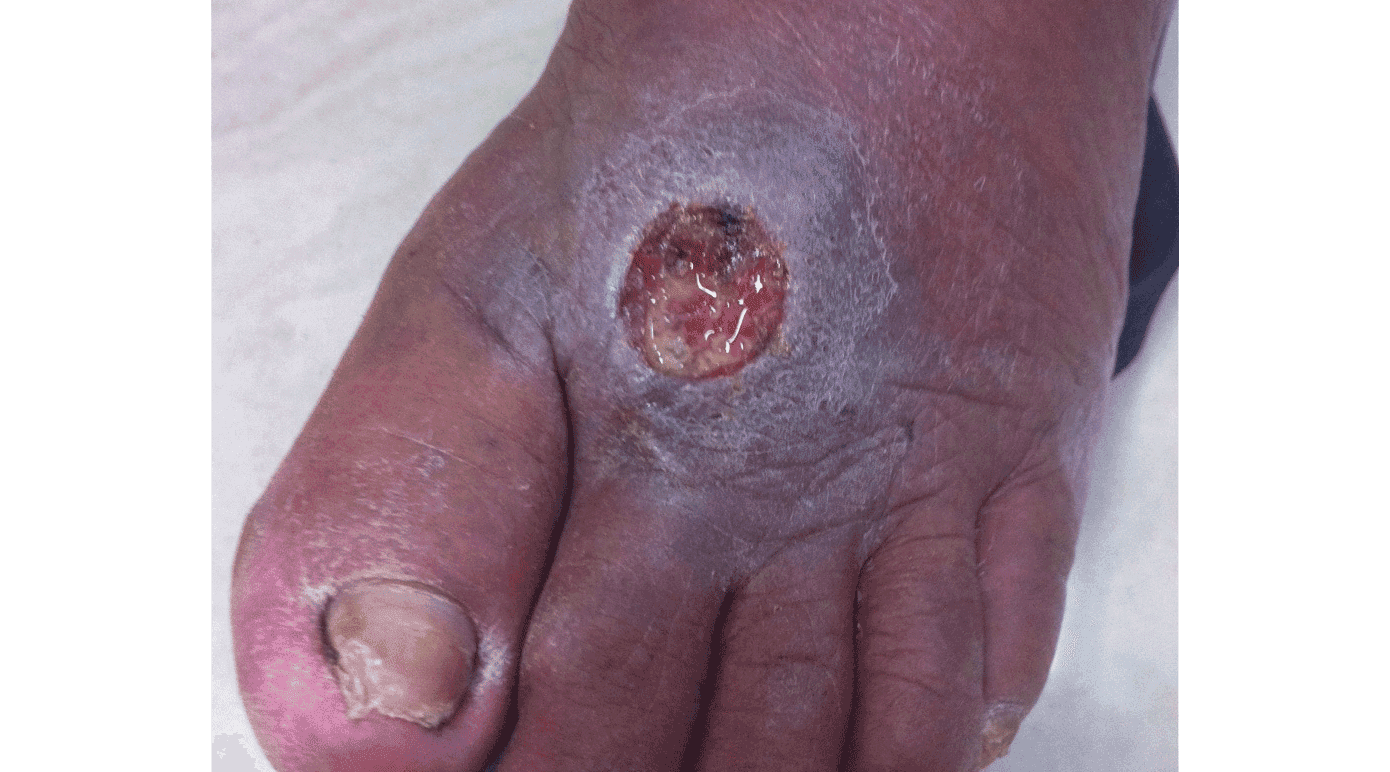
Initialt ses der små papler ved sandfluens bid, der kan progrediere over uger til en nodulus og derefter oftest til et smertefrit sår med voldformede rande (Figur 2). Der kan være et eller flere elementer. Når der er flere på samme anatomiske lokalisation, følger de ofte lymfekarrene. Læsionerne kommer uger eller måneder efter ekspositionen. I nogle tilfælde kan der optræde hyperkeratotiske eller skorpedækkede plaques, og satellitlæsioner kan forekomme. Systemiske symptomer er sjældne, men der kan være subfebrilia i begyndelsen, og lokale lymfeknuder kan være hævede. Ofte begynder helingen af læsionerne spontant efter flere måneder op til 1-3 år. Ved diffus, kutan leishmaniasis ses ikkeulcererende læsioner, som optræder over hele kroppen.
Mukokutan leishmaniasis
Mukokutan leishmaniasis ses hyppigst hos rejsende eller immigranter fra Syd- og Mellemamerika. Der kan opstå læsioner på slimhinderne i næsen, munden, svælget og struben (Figur 3). Læsionerne opstår ofte måneder til år efter initiale hudlæsioner, der ikke nødvendigvis har været behandlingskrævende eller har ført til lægekontakt. Der er forøget risiko for mukokutan sygdom, hvis hudlæsioner ikke bliver behandlet tilstrækkeligt. Sygdommen begynder ofte i slimhinden i den forreste del af næseseptum og er ofte lokaliseret omkring næsebor på overgangen mellem slimhinde og hud med hævelse og deformering til følge. Regional lymfangitis og lymfadenitis kan forekomme.
Visceral leishmaniasis
Visceral leishmaniasis (kala-azar) ses overvejende hos småbørn, ældre eller immunsvækkede personer. Sygdommen udvikler sig typisk langsomt over måneder og debuterer ofte måneder eller år efter ekspositionen. Symptomerne er vedvarende eller intermitterende feber samt almene symptomer som træthed, vægttab og nattesved. Patienterne har ofte hepatosplenomegali og universel lymfeknudesvulst. Eventuelt ses eruptioner, sår samt petekkier og blødninger i næse og mundhule. Sent i forløbet ses ikterus, ødemer og ascites. Uden behandling er tilstanden ofte dødelig. Biokemisk ses leukopeni, anæmi, trombocytopeni, hypergammaglobulinæmi, forhøjede levertal og proteinuri.
Post-kala-azar dermal leishmaniasis
Post-kala-azar dermal leishmaniasis er et syndrom med hudlæsioner (erytematøse eller hypopigmenterede maculae, papler eller noduli) hyppigst i ansigtet, der udvikler sig under eller efter behandling for visceral leishmaniasis.
Det er vigtigt at være opmærksom på den forøgede risiko hos immunsvækkede patienter. Leishmaniasis kan ligge latent i kroppen og først foranledige sygdom, når immunsystemet bliver svækket. I mange år har det været en sygdom særligt hos personer med hiv [6], og der har været flere tilfælde med mere udtalte manifestationer grundet tumornekrosefaktorhæmmende behandling. Hos immunsvækkede patienter kan det dreje sig om såvel flere og sværere kutane elementer, udvikling af mukokutan sygdom [7] som udvikling af visceral leishmaniasis. Den kliniske præsentation kan være atypisk hos personer med nedsat immunforsvar, f.eks. set det ofte, at disse personer ikke har hepatosplenomegali. Dette kan medføre fejldiagnose eller forveksling med en forværring af den underliggende sygdom [8]. Ved uforklaret hæmofagycytose og samtidig behandling med immunsupprimerende stoffer bør man overveje at teste for leishmaniasis med PCR-test på knoglemarv [9, 10]. Blandt patienter, der tidligere er behandlet for leishmaniasis, er der risiko for recidiv, hvis patienterne siden starter immunsupprimerende behandling.
Det er værd at nævne, at behandling med immunmodulerende stoffer kan sænke det Leishmania-specifikke antistof-niveau. Grundet dette og den generelt lave positivrate kan antistofscreening ikke for nuværende anbefales hos immunsvækkede patienter [11].
De vigtigste differentialdiagnoser til kutan leishmaniasis er andre infektioner (såsom ecthyma, furunkler, syfilis, svampe- eller mykobakterieinfektioner) eller malignitet [12]. Differentialdiagnoser til visceral leishmaniasis omfatter hæmatologiske lidelser (leukæmi eller lymfom), reumatologiske lidelser (f.eks. reumatoid artritis) eller andre infektioner (bl.a. tuberkulose, brucellose, histoplasmose eller endokarditis) [3].
PCR
Ved mistanke om leishmaniasis tages en vævsprøve fra relevant område til PCR-test. Dette kan være hud- eller slimhindebiopsier ved mistanke om kutan eller mukokutan leishmaniasis eller knoglemarv eller prøver fra lever eller milt ved mistanke om visceral leishmaniasis. PCR-test varetages primært af SSI. Resultatet af analysen angives som »Leishmania sp. påvist/ikke påvist«, og hvis Leishmania sp. påvises, følger svar vedrørende artsspecifikation [13].
Antistoftest
Ved formodning om visceral leishmaniasis kan der undersøges for Leishmania-specifikke antistoffer, som registreres som »positiv«, »gråzone« eller »negativ«. Analysen kan ikke benyttes til diagnostik af kutan leishmaniasis, da der sjældent udvikles antistoffer. Antistoftest kan være relevant ved udredning for hepatosplenomegali og/eller knoglemarvssuppression af ukendt årsag hos patient med mulig eksposition. Mange immunsvækkede patienter udvikler dog ikke påviselige antistoffer, hvilket specielt er undersøgt hos personer, der lever med hiv [14, 15].
Man kan hverken bruge PCR-test eller antistoftest til at monitorere behandlingsrespons, da disse test formentlig kan forblive positive længe efter endt kurativ behandling.
Histologi
Diagnosen kan også stilles ved histologisk undersøgelse af en biopsi. Ved leishmaniasis ses inflammatoriske forandringer med infiltrater af lymfocytter, makrofager og plasmaceller, eventuelt med granulocytter, kæmpeceller og granulomer. Parasitterne kan ofte påvises intracellulært i makrofager og histiocytter [12].
Af hensyn til bekræftelse af diagnose, artsspecifikation og sygdomsovervågning anbefales det at sende en biopsi til PCR-undersøgelse ved et positivt antistofsvar eller ved histologiske fund forenelige med diagnosen.
Ved mukokutan leishmaniasis og visceral leishmaniasis er der altid indikation for systemisk behandling. Ved kutan leishmaniasis afhænger behandlingsindikationen af antallet af læsioner, deres størrelse, om der er tegn på spontan bedring, Leishmania-art, og om patienten er immunkompetent [3]. Kutan leishmaniasis kan i nogle tilfælde ses an uden behandling, men behandles oftest enten med systemisk eller lokal behandling.
Systemisk behandling
Systemisk behandling anbefales ved infektion med arter, der kan forårsage: mukokutan sygdom (Figur 3), hævede lymfeknuder, > 4 læsioner, store læsioner (≥ 5 cm), læsioner i ansigt eller steder, hvor lokal behandling ikke er mulig, eller infektion hos immunkompromitterede patienter [3].
Ved indikation for systemisk behandling bruges i Danmark enten miltefosin peroralt (kræver særlig tilladelse fra Lægemiddelstyrelsen) eller liposomal amphotericin B intravenøst. Fluconazol kan overvejes i tilfælde med simple sår hos immunkompetente personer forårsaget af arter, der ikke er associeret med risiko for mukokutan infektion, om end evidensen er sparsom. Både miltefosin og liposomal amphotericin B giver ofte betydelige bivirkninger. De hyppigste bivirkninger til miltefosin er kvalme, opkastninger, leverpåvirkning og nyrepåvirkning [16]. De hyppigste bivirkninger til liposomal amphotericin B er infusionsreaktioner og nyrepåvirkning.
Lokal behandling
Lokal behandling omfatter kryoterapi eller intralæsionelle injektioner med megluminantimoniat. Tidligere har man brugt natriumstibogluconat, men dette kan på nuværende tidspunkt ikke skaffes.
Leishmaniasis er en sjælden parasitsygdom importeret fra troperne og subtroperne, herunder Sydeuropa. Den kan manifestere sig som enten kutan, mukokutan eller visceral sygdom. Kutan sygdom er langt den hyppigste, og man bør have mistanke herom ved kronisk sår hos relevant eksponeret patient. I Danmark ses visceral sygdom primært hos immunsvækkede personer og skal overvejes hos patienter med eksponering samt feber, vægttab, hepatosplenomegali, pancytopeni og hypergammaglobulinæmi. Diagnosen bekræftes oftest med en PCR-test eller histologi. Antistoftest bør udelukkende bruges ved formodning om visceral leishmaniasis. Behandlingen varetages af specialister, oftest infektionsmedicinere, og kan være enten lokal eller systemisk.
Korrespondance Mike Zangenberg. E-mail: mikezangenberg@gmail.com
Antaget 23. februar 2024
Publiceret på ugeskriftet.dk 22. april 2024
Interessekonflikter Der er anført potentielle interessekonflikter. Forfatternes ICMJE-formularer er tilgængelige sammen med artiklen på ugeskriftet.dk
Taksigelser Lisa Leth Maroun, Afdeling for Patologi, Rigshospitalet, for hjælp til formulering af afsnit om histologi
Referencer findes i artiklen publiceret på ugeskriftet.dk
Artikelreference Ugeskr Læger 2024;186:V09230568
doi 10.61409/V09230568
Open Access under Creative Commons License CC BY-NC-ND 4.0
Leishmaniasis is transmitted by sandflies and involves cutaneous, mucocutaneous, or visceral disease. Sporadic, imported cases in Denmark emphasize the need for greater awareness. The incidence is stable with at least ten verified cases per year. Diagnostic methods include PCR- and antibody tests with a high positivity rate for PCR (17%) and a low positivity rate for antibody (1.4%). The latter should be used only when visceral disease is suspected. Immunosuppressed patients are at particular risk. Treatment strategies are chosen according to the severity of the condition, as argued in this review.