Intraoperativ neuromonitorering under intradural spinalkirurgi

Søren Fjord-Larsen1, 2, 3, Mikkel Mylius Rasmussen4, 5, Gudrun Gudmundsdottir4, Jakob Gram Carlsen4, Mindaugas Bazys4, Erisela Qerama Montvilas6, Hatice Tankisi6, Kaare Stenhøj Meier7, Frantz Rom Poulsen1, 2, 3 & Halldór Bjarki Einarsson4, 5
I denne artikel gennemgås rationalet ved anvendelsen af intraoperativ neuromonitorering (IONM) i generel anæstesi (GA) ved intradural spinalkirurgi. IONM i GA under hjerneoperationer er netop tidligere gennemgået i Ugeskrift for Læger [1], hvorfor denne artikel kan ses som en forlængelse af det tidligere manuskript. Her vil vi gentage vigtigheden af fokus på førsteneuronpåvirkning og brug af IONM i GA hos rygpatienter, der har intradural spinal patologi. Hovedformålet er at præsentere metoden for kirurger i Danmark, der påtænker at tage brug af denne. Fordele og ulemper er inkluderet (Tabel 1 og Tabel 2).
Hovedbudskaber
IONM ved intradural kirurgi er en realtids neurofysiologisk og peroperativ paraklinisk tilgang under kirurgisk behandling af bl.a. intradurale tumorer, syringomyeli og tethered spinal cord syndrome [6-8]. På grund af den anatomiske lokation og deraf begrænsede plads ved denne type af kirurgi samt den kirurgiske manipulation og ledsagende mekaniske stress udsættes rygmarven for potentiel iatrogen beskadigelse peroperativt. For at mindske risikoen for komplikationer anvendes IONM. Denne metode gør det muligt at identificere og monitorere den funktionelle integritet af rygmarven gennem flere elektrofysiologiske modaliteter [2, 3, 9, 10]. Dette omfatter en vurdering af både de ascenderende sensoriske fibre via somatosensoriske evokerede potentialer (SSEP) og de descenderende motoriske baner via motoriske evokerede potentialer (MEP), og derudover kan nerverøddernes integritet monitoreres og mappes via elektromyografi (EMG). IONM kan således give realtidsfeedback til kirurgen, og derved mindskes risikoen for blivende neurologisk skade. Fordele ved selve metoden overordnet set præsenteres i Tabel 1.
Patienter med mekanisk rygmarvspåvirkning kan være svære at diagnosticere. Den kliniske præsentation er afhængig af anatomisk placering, men væsentlige medullære symptomer omfatter både rygsmerter, radikulære og centrale smerter, motoriske udfaldssymptomer, sensibilitetsforstyrrelser samt ofte Lhermittes tegn. Ved beskadigelse af de motoriske ledningsbaner, omfattende tractus corticospinales, kan der opstå et øvre motorneuronsyndrom. Symptomerne omfatter bl.a. styringsbesvær og parese af ekstensormuskelgrupperne i armene og fleksorerne i benene. Karakteristisk er også den øgede muskelaktivitet, som kan give ophav til spasticitet med tonusøgning og hyperrefleksi, klonus og eventuelt et positivt Babinskirespons. Sfinkterforstyrrelser er ikke hyppige, men urgeinkontinens er et klassisk symptom.
Ved påvirkning af bagstrengs-lemniscus medialis-ledningsbanesystemet (BLM) og/eller det anterolaterale ledningssystem, vil der opstå sensibilitetsforstyrrelser i form af f.eks. hypæstesier og paræstesier. Til tider kan der opstå syringomyeli sekundært til spinale sygdomme. Dette medfører affektion af nociception/temperatursansen qua fibrenes overkrydsning, men med relativt bevaret taktil og proprioceptiv sans (kommisuralt syndrom) og oftest ledsaget af infranukleær motorisk affektion på niveau med patologien [11, 12].
Somatosensoriske evokerede potentialer
SSEP anvendes til vurdering af integriteten af de sensoriske ledningsbaner fra den perifere nerve gennem BLM i den bagerste del af rygmarven og op til den kontralaterale somatosensoriske cortex (Brodmanns area 3a, 3b, S 1 og S2). Ved denne teknik stimuleres de perifere nerver gentagne gange, typisk n. medianus i overekstremiteterne og n. tibialis i underekstremiteterne. Der registreres perifere signaler via overfladeelektroder, som er placeret over Erbs punkt/fossa poplitea, og spinale signaler ved overfladeelektroder, som er placeret over C7/ Th12. Det kortikale signal registreres oftest ved hjælp af skrueelektroder, som placeres på skalpen over den somatosensoriske cortex. SEP-signalerne har typisk små amplituder på 0,1-2 μV, hvorfor gennemsnittet af 300-500 stimulationer anvendes (temporalsummation). Det er vigtigt, at et stabilt og reproducerbart signal ved baseline opretholdes.
SSEP monitoreres kontinuerligt under en operation med etablerede retningslinjer for, hvornår ændringerne er signifikante; en reduktion af amplituden på > 50% eller en forlængelse af latenstiden på > 10% fra baseline bruges som udgangspunkt. Af disse to parametre er ændringen i amplituden mest relevant, da beskadigelse af BLM uden amplitudeudsving er usandsynligt. Forekommer der ændringer i SSEP, skal kirurgen underrettes, hvilket understreger vigtigheden af det multidisciplinære samarbejde mellem kirurgen, anæstesiologen og neurofysiologen. Herved kan årsagen afsøges, og signalet kan forsøges normaliseret, da f.eks. hypotermi, hypotension og de anvendte anæstesimidler (især halogenerede inhalationsanæstetika) vil have en indvirkning [3].
Ud over at give et indblik i sensibilitetsstatus giver SSEP-monitorering indirekte en indikation på integriteten af de motoriske ledningsbaner, da f.eks. mekanisk eller iskæmisk beskadigelse typisk påvirker flere ledningsbaner. Blandt andet har et multicenterstudie vist, at postoperativ paraplegi kan reduceres med 50-60%, og at sensitiviteten er på 25-92%, samt at specificiteten for metoden ligger på 96-100% [3, 13]. Dette er dog ikke gældende ved intramedullær tumorresektion, da den funktionelle integritet af sensoriske og motoriske ledningsbaner kan påvirkes forskelligt. Flere studier har samtidigt demonstreret tilstedeværelsen af falsk negative og falsk positive resultater ved forskellige procedurer [2, 14, 15]. Derfor kan SSEP ikke stå alene som monitoreringsteknik, da teknikken således har sine begrænsninger (Tabel 2) [3, 16].
Motoriske evokerede potentialer
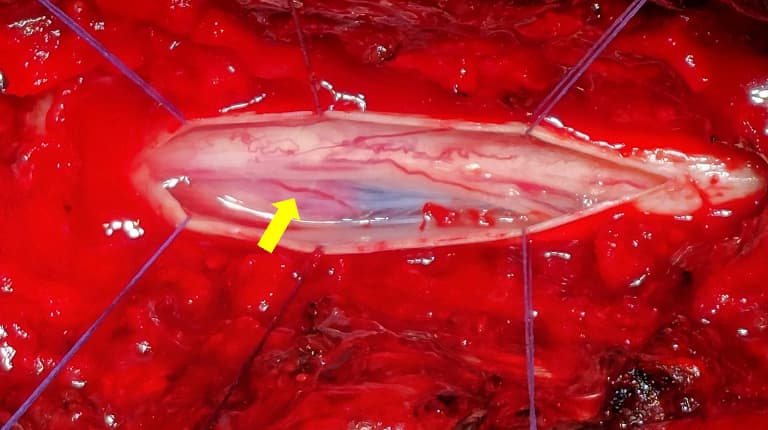
Ved resektion af intradurale tumorer (Figur 1) anvendes MEP, da det giver muligheden for direkte peroperativ overvågning af integriteten af de motoriske ledningsbaner, heriblandt tractus corticospinalis. Dette gøres ved at placere skrueelektroder på skalpen, epiduralt i rygmarvskanalen både rostralt og kaudalt for tumoren og nåleelektroder i relevante perifere muskler til registrering af elektromyografisk aktivitet. Herefter kan den motoriske cortex stimuleres transkranielt på to måder: Enten via en »enkeltstimulusteknik«, der fremkalder et direct (D)-wave respons i rygmarven, eller via en såkaldt højfrekvent short train-teknik med flere »tog« (train of four (TOF)) af impulser, der giver et EMG-respons i de perifere muskler (Figur 2), dvs. et såkaldt muskel-MEP (mMEP) [14, 17].
D-waves viser aktionspotentialer i motoriske førsteordensneuroner, og ved at sammenligne målingerne fra elektroden placeret kaudalt for tumoren med den rostrale (baseline) elektrode kan ændringer i peak-to-peak-amplituden sammenlignes. Her fungerer en reduktion på 20% som en indledende advarsel mod peroperativ beskadigelse, hvorimod en reduktion på 50% er associeret med signifikante postoperative motoriske udfald [3, 18]. Forlængelse af latenstiden ses ikke som en signifikant indikator for beskadigelse, da flere faktorer har en indvirkning herpå [14].
Samtidig kan mMEP måles, hvor den motoriske cortex aktiveres via højfrekvente elektriske impulser i stimulationstog, som sendes via elektroden i skalpen gennem de lange fiberforbindelser til rygmarven og derved aktiveres α-motorneuroner i forhornene. Herefter monitoreres der for et muskelrespons via nåleelektroderne indsat i de muskler i over- og underekstremiteten (Figur 2), der kan være udsat for denervering under indgrebet. For at sikre, at signalændringer er signifikante, bruges ofte en »alt eller intet-tilgang«, da mMEP-amplituden varierer [14, 18].
De fleste MEP-signalændringer forekommer mod slutningen af en resektion, hvor kirurgen nærmer sig grænsen mod det raske væv. Ved en lettere reduktion af signalet kan kirurgen intervenere ved f.eks. at udvaske ophobet kalium og cellulære metabolitter fra det omkringliggende væv. Typisk vil hypertension også kunne induceres ved systemisk administration af vasopressorer, således at den lokale perfusion af rygmarven øges, og iskæmi derved hindres [14]. Sidst, og vigtigst, kan operationen pauseres, hvor der evalueres på patientens neurologiske status gennem flere modaliteter. På baggrund af dette vil kirurgen have den fornødne information til at træffe den afgørende beslutning om mængden af den patologiske proces, der på forsvarligvis kan bortopereres [16].
Derudover kan den bulbokavernøse refleks (BCR) monitoreres for at evaluere sfinkterfunktionen peroperativt, og dette vil give en indikation af om S2-S4-refleksbuerne er intakte eller ej. For at fremkalde BCR kan der anvendes et »short-train-stimulus«. Ses refleksen, er det indikation på opretholdt sfinkterkontrol, hvorimod peroperativt tab af BCR vil medføre om ikke andet, så et forbigående tab af sfinkterstyring [19, 20].
Elektromyografi
Der skelnes mellem to elektromyografiske teknikker, der kan inddeles efter, hvordan de fremkalder det signal, der registreres i musklerne.
Trigger-EMG bruges til at opfange muskelaktivitet, når en spinalstruktur stimuleres. Her lokaliseres denne ved hjælp af EMG-aktiviteten, der registreres i de muskler, som den givne struktur innerverer. Metoden kan anvendes ved nerverodstest, nerve proximity-test og pedikelskruetest.
Free-running-EMG bruges til spontanmonitorering af funktionen af nerverødderne. Hvis en nerverod påvirkes ved mikrotraume eller træk, kan der registreres spontant vedvarende EMG-aktivitet af de muskler, den undersøgte nerverod innerverer [21]. Med andre ord kan et såkaldt free-running-EMG bruges til monitorering af funktionen af en nerverod, som er påvirket, før dekompression og resektion af en intradural tumor, idet risikoen for postoperativ radikulopati her er fremtrædende. Denne type af EMG kræver ingen stimulation og kan kontinuerligt monitoreres i udvalgte muskler, baseret på hvilken nerverod der undersøges. Er en nerverod upåvirket, ses ingen muskelaktivitet, men ved irritation forårsaget af f.eks. manipulation eller termisk beskadigelse vil der ses et mikrotraume, der fremkalder en depolarisering af spinalnerven. Afhængigt af omfanget vil amplituden og frekvensen ændres, hvor der enten ses mindre sporadiske »bursts«, eller »sustained-train-aktivitet«, der indikerer vedvarende irritation [22]. Gunnarsson et al fandt, at teknikken har en sensitivitet på 100% til registrering af nye postoperative udfaldssymptomer og en specificitet på 23,7% [23]. Et ændret free-running-EMG vil derfor ikke nødvendigvis være prædiktivt for kliniske udfaldssymptomer postoperativt, da irrigation med koldt vand og kauterisering kan give en falsk aktivering, men også da den kontinuerlige monitorering giver kirurgen mulighed for at ændre teknik undervejs. Dette kan være en forklaring på den lave specificitet, pga. en forhøjet mængde af falsk positive signaler [3]. Til gengæld er et normalt respons prædiktivt for en intakt nerverod.
Anvendelsen af både free-running-EMG og trigger-EMG er særdeles nyttig og bruges i stigende grad i forbindelse med andre former for rygkirurgi. Dette skyldes den øgede incidens af instrumentering, hvor der ved registrering af nervepåvirkninger rettidigt kan interveneres for at minimere risikoen for alvorlige komplikationer [3]. Ved begge EMG-typer er anvendelse af muskelrelaksantia kontraindiceret. Øvrige ulemper og fordele for de forskellige modaliteter er angivet i Tabel 2.
Anvendelsen af IONM under intradural spinalkirurgi omfatter forskellige modaliteter, der vurderes at kunne øge den funktionelle integritet af de intradurale strukturer, for at disse opretholdes peroperativt. Dette kan opnås ved hjælp af SSEP, MEP og EMG. Det er imidlertid afgørende at forholde sig til de forskellige styrker og svagheder ved de enkelte monitoreringsmodaliteter. Det tværfaglige samarbejde mellem kirurgen, anæstesiologen og neurofysiologen kommer særligt til udtryk i denne proces. IONM er vurderet at være omkostningseffektivt og har potentiale til at forbedre det postoperative resultat ved flere intradurale procedurer, og en mestring af teknikken kan øge patientsikkerheden [6, 14, 16, 24].
Korrespondance Halldór Bjarki Einarsson. E-mail: halleina@rm.dk
Antaget 29. november 2022
Publiceret på ugeskriftet.dk 16. januar 2023
Interessekonflikter Der er anført potentielle interessekonflikter. Forfatternes ICMJE-formularer er tilgængelige sammen med artiklen på ugeskriftet.dk
Referencer findes i artiklen publiceret på ugeskriftet.dk
Artikelreference Ugeskr Læger 2023;185:V08220514
Søren Fjord-Larsen, Mikkel Mylius Rasmussen, Gudrun Gudmundsdottir, Jakob Gram Carlsen, Mindaugas Bazys, Erisela Qerama Montvilas, HaticeTankisi, Kaare Stenhøj Meier, Frantz Rom Poulsen & Halldór Bjarki Einarsson
Ugeskr Læger 2023;185:V08220514
Intraoperative neuromonitoring (IONM) allows for a perioperative evaluation of the functional integrity of the spinal cord and nerve roots during intradural neurosurgery. This review examines established techniques as somatosensory evoked potentials and motor evoked potentials, as well as electromyography which all provide real-time feedback for the surgical team. IONM represents a valuable tool which can identify emerging neurological complications, and thus can be utilised to reduce the incidence of postoperative neurological deficits by timely interventions.