Kemoterapiinduceret perifer neuropati blandt brystkræftoverlevere

Mie Collin Lund Sloth1, Marie Louise Aarønæs Thybo1, Anders Bonde Jensen2, Lise Ventzel3, 4 & Michael Pedersen1
I løbet af de seneste årtier er der sket stor fremgang i behandlingen af kræftsygdomme, hvilket har resulteret i et stigende antal patienter, der har overlevet kræft i Danmark. I udgangen af 2022 var der ca. 385.000 personer i Danmark, der levede med eller efter en kræftdiagnose [1]. Med denne udvikling er der opstået nye udfordringer i form af de senfølger, som den mere intensive behandling medfører. Kemoterapiinduceret perifer neuropati (CIPN) er en hyppig og i nogle tilfælde alvorlig senfølge, som kan nedsætte livskvaliteten markant for de ramte [2, 3]. CIPN skyldes ofte de kendte neurotoksiske stoffer vincaalkaloider, platiner, taxaner og bortezomib, som er grundsten i behandlingen af hyppige kræftformer som bl.a. bryst-, tarm-, prostata-, lungekræft og myelomatose [4, 5].
I denne artikel beskrives brystkræftrelateret CIPN i Danmark, herunder karakteristik, diagnostik, behandling og håndtering af CIPN i sundhedsvæsenet i dag.
Brystkræft i Danmark
Hvert år får ca. 4.900 danske kvinder stillet diagnosen brystkræft, og det er i dag den hyppigste kræftsygdom blandt kvinder. Overlevelsen er steget markant de seneste år, og den relative overlevelse efter et og fem år er nu hhv. 97,5% og 90,3% [6]. Ved udgangen af 2020 var der 73.925 kvinder, der levede med brystkræftdiagnosen [7].
Behandlingen omfatter kirurgi, stråleterapi og medicinsk behandling, som indbefatter kemoterapi, endokrin-, antistof- og immunbehandling. Kemoterapien kan gives neoadjuverende eller adjuverende og udgør en hjørnesten i behandlingen. Årligt vil ca. 2.200 patienter med de nuværende retningslinjer modtage kemoterapi som en del af kræftbehandlingen [7]. Taxanerne paclitaxel og docetaxel er vigtige i behandlingen af brystkræft. De kan gives i kombination med antracyclin, cyclophosphamid og carboplatin eller som monoterapi. Behandlingen består af 4-8 serier fordelt over 12-24 uger [7].
Karakteristik af kemoterapiinduceret perifer neuropati
CIPN kan opstå under eller umiddelbart efter behandling med kemoterapi eller opstå forsinket, typisk uger til måneder efter afsluttet behandling. Risikoen for at udvikle CIPN kan være afhængig af både den enkelte dosis og kumuleret dosis [8]. Der er beskrevet cases med svær CIPN efter ganske få doser, hvilket understøtter hypotesen om, at der eksisterer ukendte risikofaktorer for udviklingen. I mange tilfælde aftager symptomerne efter endt behandling, men hos en andel af patienterne bliver symptomerne kroniske [8, 9]. Et dansk prospektivt studie fra 2015 har vist, at 44,8% af brystkræftpatienter behandlet med adjuverende docetaxel oplever symptomer som ved CIPN ét år efter opstart af kemoterapi [2]. Et femårs opfølgende studie har vist, at der ikke er signifikant forskel på antallet af patienter med symptomer på CIPN efter hhv. et og fem år. Dette indikerer, at generne vil være et kronisk problem hos patienter, der fortsat oplever dem efter ét år [3].
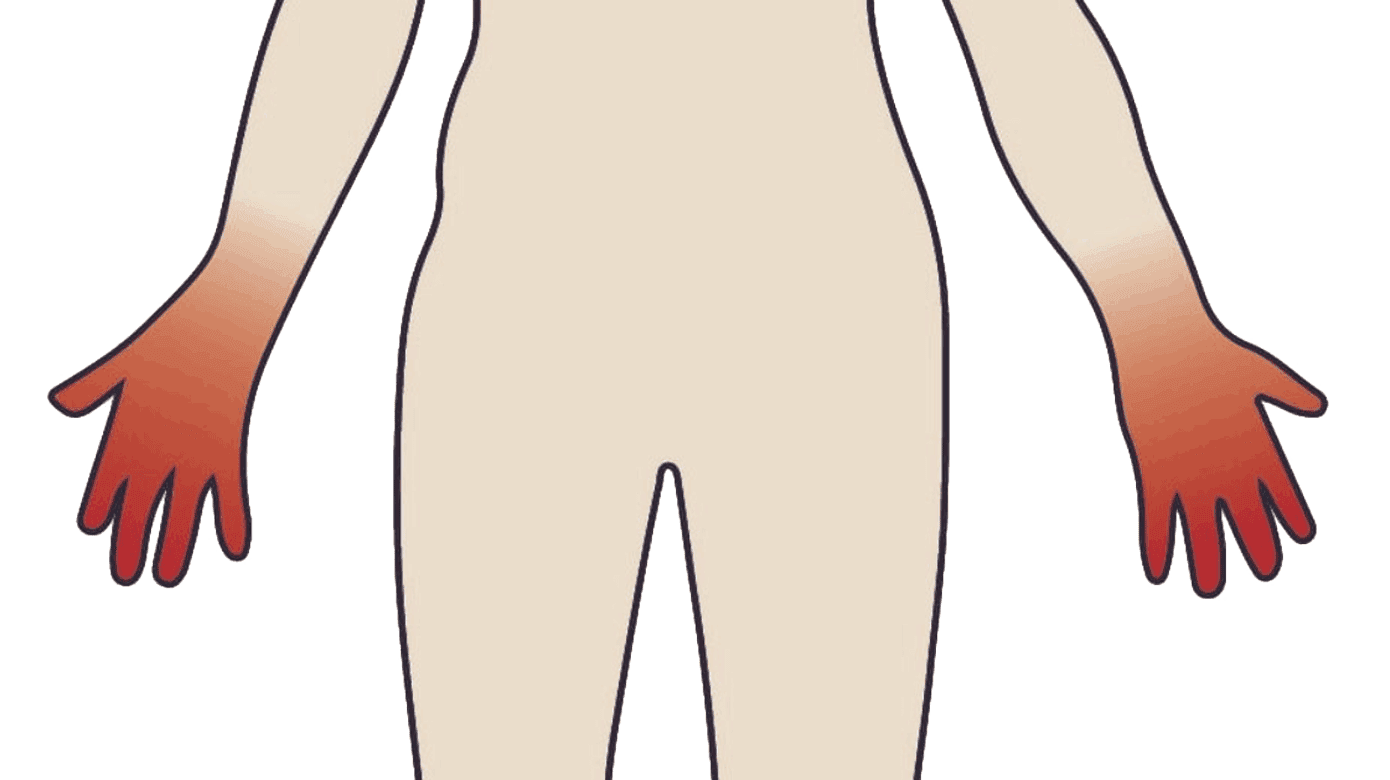
CIPN afficerer oftest sensoriske nerver, men kan også involvere motoriske og sjældnere autonome nerver [10]. Taxaninduceret neuropati involverer hovedsageligt små sensoriske nerver [8, 9]. Den sensoriske neuropati er en klassisk længdeafhængig neuropati, hvilket vil sige, at symptomerne starter og er mest udtalt perifert i ekstremiteterne og kan udvikle sig proksimalt. Symptomerne er karakteriseret ved ændret sensibilitet på hænder og fødder i »strømpe- og handskeområdet« (Figur 1). Sensibilitetsændringerne kan f.eks. manifestere sig som en summende fornemmelse, ændret følsomhed over for temperatur, følelsesløshed og en følelse af at gå på puder eller vat. Neuropatien kan også indebære neuropatiske smerter, der ofte beskrives som en brændende fornemmelse eller med karakter af elektriske stød. I nogle tilfælde er proprioceptionssansen påvirket, hvilket kan resultere i balanceproblemer og øget faldtendens [8]. Risikoen for udvikling af motoriske og autonome symptomer stiger med højere akkumuleret dosis [8, 9, 11].
Udredning
Der findes endnu ikke en universel accepteret metode til udredning og diagnosticering af CIPN. Da der i langt de fleste tilfælde er tale om en klassisk længdeafhængig neuropati, er det rimeligt at bruge erfaring og metoder fra andre lignende neuropatier [12]. Nerveledningsundersøgelser er sjældent sensitive i undersøgelsen af småfiberneuropati, da de er bedst egnede til måling af tykke myeliniserede nervefibre. Udfordringen ved brug af nerveledningsundersøgelser er tidligere beskrevet i litteraturen, og fokuseret somatosensorisk undersøgelse med smerte- og varmestimuli samt hudbiopsier kan derimod være værdifulde i diagnosticeringen [12]. Spørgeskemaer til selvrapportering kan anvendes som et understøttende værktøj, og der findes flere anerkendte spørgeskemaer fra neuropatiforskningen, f.eks. The Michigan Neuropathy Screening Instrument og Douleur Neuropathique 4 Questions [13, 14]. Spørgeskemaer kan ikke stå alene som diagnostisk redskab, men kan bidrage til at klarlægge udvikling og sværhedsgrad af tilstanden.
I praksis er diagnosen ofte baseret på anamnese, hvor debut af klassiske symptomer har tidsmæssig sammenhæng med relevant neurotoksisk behandling. Dette understøttes evt. af en kort bedside undersøgelse [8, 11].
Hvis der opstår CIPN under igangværende behandling med taxaner, kan man vælge at dosisreducere, udsætte næste behandling eller i sidste ende stoppe behandlingen med stoffet for at mindske risikoen for kroniske symptomer [15]. Der findes på nuværende tidspunkt ingen danske onkologiske retningslinjer for behandling af CIPN. I vejledningen til behandling af CIPN i almen praksis i Danmark anbefales en serotonin and noradrenaline reuptake inhibitor (SNRI), f.eks. duloxetin [16]. Anvendelse af tricykliske antidepressiva og neuroleptika (gabapentin) kan ifølge denne vejledning forsøges, men dokumentation for effekten er begrænset [16]. De nyeste amerikanske og europæiske retningslinjer fra 2020 anbefaler duloxetin til behandling af kronisk smertefuld CIPN. Evidensen er dog baseret på få studier, og sekundær analgetisk behandling kan være behæftet med bivirkninger. Desuden har duloxetin vist større effekt hos patienter, der er blevet behandlet med platiner, end hos patienter, der er blevet behandlet med taxaner [15, 17]. Adskillige farmakologiske og nonfarmakologiske interventioner er undersøgt uden fund af signifikant reduktion af symptomer [15]. Eksempler på dette er behandling med tricykliske antidepressiva, cannabinoider og antiepileptika som gabapentin og pregabalin, derudover administration af kutangel indeholdende analgetika samt træningsterapi og akupunktur [15]. Et nyere review fra 2023 bekræfter, at der ikke findes en entydig god behandling af smerter eller andre symptomer relateret til CIPN [18]. Der beskrives kun en moderat forbedring af smertefuld CIPN ved behandling med duloxetin samt ved fysisk træning og akupunktur [18]. På nuværende tidspunkt findes der altså ingen entydig god behandling af smertefuld CIPN. Det bedst dokumenterede farmakologiske behandlingsforslag er duloxetin.
Efter endt onkologisk behandling følges patienterne i varierende tidsrum i relevante ambulatorier på kræftafdelingerne. Hvis patienterne allerede på det tidspunkt har CIPN, kan problemet identificeres og håndteres i hospitalsregi. I mange tilfælde vil det dog være patientens egen læge, som konfronteres med neuropatien og derefter må koordinere en videre behandling.
I en rapport fra Kræftens Bekæmpelse fra 2022 fremgår det, at kun 34% af de praktiserende læger mener, at de i meget høj/høj grad har kompetencerne til at vurdere patienters fysiske senfølger efter kræftbehandling [19]. Samme rapport viser, at kun 8% af lægerne mener, at de i meget høj/høj grad får fyldestgørende information fra hospitalerne om bivirkninger og senfølger ved kræftbehandlingen. Kun 18% mener, at de i meget høj/høj grad får nok information om, hvem der er ansvarlig for opfølgning. Rapporten viser også, at 29% af de patienter, der har overlevet kræft, ikke ved, hvem de skal kontakte, hvis de oplever tegn på senfølger [19]. Dette vidner om, at samarbejdet om kræftopfølgning ikke fungerer optimalt, og at der mangler systematisk håndtering af senfølger, herunder CIPN.
I Danmark er der i nogle regioner etableret klinikker, som er specialiseret i håndtering af senfølger efter kræft og kræftbehandling. Patienter kan henvises hertil af både hospitalslæger og almenpraktiserende læger ved komplekse problemstillinger. Der findes i dag fire klinikker i Region Syddanmark, én klinik i Region Sjælland samt én nyopstartet klinik i Region Hovedstaden, som patienter, der har overlevet brystkræft, kan henvises til [20]. Klinikkerne kan modtage henvisninger fra andre regioner, men de har begrænset kapacitet. Derudover er der oprettet en rådgivningsenhed for brystkræftsenfølger, hvor specialister gennem videobaseret multidisciplinær team (MDT)-konference kan vejlede i patientsager. Patienter fra hele Danmark kan henvises hertil, men der er kun MDT-konference på månedlig basis eller efter behov [21]. Der er altså geografisk ulighed i senfølgehåndtering i Danmark, og der mangler kapacitet til opfølgning.
Den eneste effektive profylaktiske behandling af CIPN er dosisreduktion eller ophør af neurotoksisk behandling, før de perifere nerver tager varigt skade. Dette kan dog medføre risiko for reduceret effekt af behandlingen og dermed en øget recidivrisiko af kræftsygdommen. Meget forskning på området er rettet mod udvikling af profylaktiske interventioner til forhindring af CIPN samt identifikation af prædiktive markører for udviklingen. Resultater tyder på, at der findes en sammenhæng mellem en biomarkør for neuroaksonal skade og udviklingen samt sværhedsgraden af CIPN [22, 23]. Biomarkøren er i dette tilfælde et protein fra det neuronale cytoskelet, nemlig neurofilament light-chain, der kan måles i serum ved aksonal degeneration [22]. Biomarkøren er allerede tilgængelig i Danmark og kan bruges i diagnostikken af flere neurodegenerative sygdomme, herunder ALS og multipel sklerose [24]. Adskillige studier har undersøgt interventioner, der kan forebygge CIPN, herunder præventiv brug af duloxetin [25], træning under behandling med kemoterapi [26, 27] og meditation [28, 29]. Disse tiltag har vist lovende, men ikke overbevisende resultater. Flere studier peger på, at anvendelsen af frysehandsker og -sokker (kryoterapi) kan reducere forekomsten af CIPN [15], og dette undersøges i øjeblikket i et stort dansk studie [30].
Flere risikofaktorer for udviklingen af CIPN er allerede identificeret, herunder stigende alder og tilstedeværende neuropati (f.eks. diabetisk) og andre faktorer som rygning, nedsat nyrefunktion samt visse nukleotidpolymorfier (SNPs) øger muligvis også risikoen [9]. Biomarkører og kendskab til risikofaktorer kan udgøre vigtige kliniske redskaber til at identificere patienter, der med stor sandsynlighed vil få CIPN, og dermed muliggøre en mere målrettet præventiv indsats. Der er brug for mere forskning på området for at kunne forebygge udviklingen samt behandle CIPN hos patienter, der har overlevet brystkræft.
Korrespondance Mie Collin Lund Sloth. E-mail: au618026@clin.au.dk
Antaget 20. august 2024
Publiceret på ugeskriftet.dk 7. oktober 2024
Interessekonflikter ingen. Forfatternes ICMJE-formularer er tilgængelige sammen med artiklen på ugeskriftet.dk
Referencer findes i artiklen publiceret på ugeskriftet.dk
Artikelreference Ugeskr Læger 2024;186:V05240318
doi 10.61409/V05240318
Open Access under Creative Commons License CC BY-NC-ND 4.0
This review investigates that effective cancer treatment enhances the number of survivors in Denmark, but late complications like chemotherapy-induced peripheral neuropathy (CIPN) are a challenge. CIPN affects sensory nerves and can persist post-treatment. Diagnosis relies on symptoms and the medical history. Treatment options are limited and management faces geographic disparities and clinical capacity issues. Future research targets predictive markers and possible preventative interventions. CIPN, among other late complications, remains a significant concern in survivorship care.