Lokal immunpatologi ved COVID-19-associeret lungesvigt

Andreas Ronit1, Ronan M.G. Berg2, 3, 4, Trine H. Mogensen5, 6 & Ronni R. Plovsing7, 8
De sundheds- og samfundsmæssige konsekvenser af COVID-19 er velkendte og betydelige. COVID-19 fører til kliniske manifestationer, der spænder fra asymptomatisk eller mild øvre luftvejssygdom til svær pneumoni, herunder akut livstruende lungesvigt, acute respiratory distress syndrome (ARDS). Respiratorbehandlet COVID-19-associeret ARDS (CARDS) er i et landsdækkende dansk kohortestudie inkluderende alle SARS-CoV-2-positive patienter indlagt på intensivafdeling i den første bølge af COVID-19-pandemien forbundet med en mortalitet på 41% [1], hvilket er sammenligneligt med opgørelser fra udlandet.
Fakta
Viden om lokal immunpatologi ved COVID-19-associeret acute respiratory distress syndrome (CARDS) er begrænset.
Bronkoalveolær lavage-væske ophentet fra lungerne fra intuberede patienter med CARDS muliggør studier heraf.
CARDS er karakteriseret ved et dysreguleret immunrespons i lungerne.
COVID-19-pandemien har ført til et fornyet fokus på ARDS. Syndromet blev første gang formelt beskrevet i 1967 [2] og har siden været underkastet forskellige konsensusdefinitioner, senest med den såkaldte Berlin-definition fra 2012 [3]. Selvom klinisk og translationel forskning i ARDS i løbet af de seneste årtier har bidraget til en bedre forståelse af patogenesen [4], er behandlingsmulighederne hovedsageligt begrænset til lungeprotektiv ventilation, bugleje, neuromuskulær blokade og ekstrakorporal membranoxygenering hos udvalgte patienter med primært refraktær hypoxæmi [4].
Viden om immunpatologien ved CARDS kan være med til at identificere nye angrebspunkter for farmakologisk behandling. Da CARDS er en følgevirkning af en direkte insult i lungerne, dvs. selve den primære infektion med SARS-CoV-2, er især lungenære analyser afgørende. Kun i et fåtal af mekanistiske studier af CARDS har man fokuseret på lungernes immunrespons. Vi vil i denne artikel introducere anvendte metoder til undersøgelse af immunresponset i lungerne hos patienter med CARDS, fremhæve ny viden om lungeimmunpatologi ved denne sygdom og med udgangspunkt heri diskutere mulige effekter af nuværende immunmodulerende behandling samt perspektiver for denne type behandling.
Undersøgelse af det lokale immunrespons ved CARDS kræver egnet materiale fra lungerne. Et af de tidligste lungemorfologiske studier var baseret på obduktionsmateriale fra 12 patienter med CARDS [5]. I dette studie kunne man dokumentere diffus alveolær skade, hyalinmembrandannelse, udbredte tromboembolier i lungernes mikrovaskulatur samt proteinrigt alveolært og interstitielt ødem, forandringer, som også kan ses ved non-COVID-19-ARDS [4]. I efterfølgende og større obduktionsbaserede studier med op til 38 patienter har man fundet tilsvarende forandringer [6]. Derudover er CARDS blevet sammenlignet med H1N1-influenzaassocieret ARDS, hvor man fandt, at mikrovaskulære tromber og neovaskularisering sås hyppigere ved CARDS [7], og endelig viste et andet obduktionsstudie, at et lokalt svagt interferonrespons og høj SARS-CoV-2-mængde i lungerne var forbundet med et senere tidspunkt for død [8]. Obduktionsstudier har således bidraget til vigtig karakteristik af lungepatologien ved CARDS og givet et indblik i det lokale immunrespons. En af de naturlige begrænsninger ved obduktionsbaserede studier er, at CARDS er undersøgt på et sent tidspunkt i naturforløbet, og fundene er svære at korrelere til kliniske endepunkter, såsom sværhedsgraden af sygdom. Derudover har der været begrænset cellulær karakteristik i denne type studier.
I et fåtal af kasuistiske studier har man anvendt vævsanalyser fra levende patienter med CARDS ved brug af transbronkial eller transtorakal lungebiopsi [9, 10]. Disse studier er primært udført på klinisk indikation og i differentialdiagnostisk øjemed, som f.eks. ved mistanke om underliggende interstitiel sygdom, og har i forhold til obduktionsstudierne ikke bidraget yderligere til forståelse af immunresponset i lungerne.
Den hyppigst anvendte metode til studie af immunresponset i lungerne ved CARDS er bronkoskopi med bronkoalveolær lavage (BAL). BAL muliggør undersøgelser af de nedre luftveje og kan desuden bruges både diagnostisk og terapeutisk, f.eks. ved håndtering af komplikationer såsom atelektase og mukøs hypersekretion, til respiratorbehandlede patienter med CARDS [11]. Der er publiceret BAL-beskrivelser af flere hundrede intuberede patienter med CARDS, og generelt er proceduren veltålt, kan udføres i både ryg- og bugleje, og bortset fra kortvarige fald i iltmætning er der ikke rapporteret om væsentlige komplikationer [12, 13]. I langt hovedparten af studierne er der kun indsamlet BAL-væske, når der klinisk har været indikation for bronkoskopi. Derudover har enkelte studier vist [14, 15], at det er muligt at udføre tidlig protokolleret BAL på inhabile patienter med CARDS efter stedfortrædende samtykke fra nærmeste pårørende. Overordnet har især BAL-studier haft et mekanistisk fokus og bidraget til en øget forståelse af det lokale immunrespons ved CARDS.
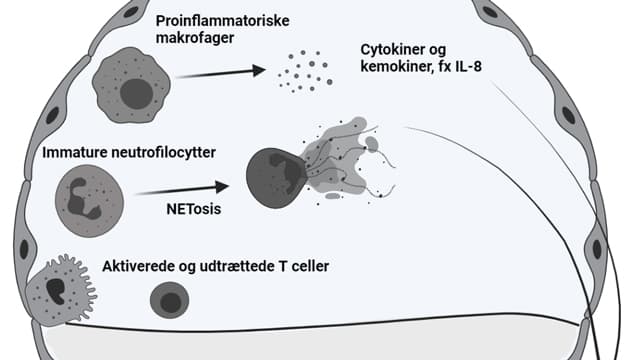
I flere BAL-studier har man undersøgt den lokale cellulære immunprofil ved CARDS ved primært at anvende flowcytometri, transkriptom og enkeltcelle-transkriptomanalyser i både mindre og større serier. Hvad angår den cellulære fordeling, er der en vis diskrepans imellem de enkelte studier. De fleste studier har vist en dominans af myeloide celler, især umodne neutrofile granulocytter og monocytderiverede proinflammatoriske makrofager [14, 16], mens andre har vist, at T-celler (både CD4, CD8 og γδ-subtyper) forekommer relativt hyppigt [17, 18]. Meget tyder på, at cellefordelingen er afhængig af timingen af BAL samt sværhedsgraden af sygdom, således at tidligere BAL-sampling er forbundet med højere andel af T-celler [17], mens sværere CARDS er associeret med en højere andel af neutrofile granulocytter [19]. I den forbindelse skal det nævnes, at SARS-CoV-2 kan inducere neutrofile ekstracellulære traps (NETs), som kan være involveret i lokal trombedannelse [20]. Derudover ses markante ændringer i ekspressionsprofilen i de enkelte celler, herunder en generel opregulering af effektorfunktioner (f.eks. ekspression af perforiner og granzymer i CD8-celler) [21], immunaktiveringsmarkører (f.eks. ekspression af CD69 og HLA-DR på T-celler og makrofager) [14], udtrætningsmarkører (f.eks. programmed cell death 1 (PD-1) på T-celler [18] samt markører for cellulær dysfunktion, herunder specifikt af neutrofile [16]. I forhold til betydningen af antiviralt interferon (IFN)-signalering i lungerne er billedet ikke helt klart, og selvom nogle studier har vist, at svær COVID-19 er karakteriseret ved reduceret eller helt manglende IFN-signalering [22], har andre vist excessivt IFN-drevet inflammation [23].
Det er muligt, at IFN-signalering har en dobbeltrolle, der kan yde essentiel tidlig beskyttelse, men samtidig kan bidrage til hyperinflammation og patologi og således være sygdomsforstærkende på et senere tidspunkt [24]. Flere studier har desuden vist opregulering af proinflammatoriske mediatorer, herunder velkendte proinflammatoriske cytokiner og kemokiner, såsom interleukin (IL)-1B, IL-6, IL-8, CXCL-10 og MP-10 i både blod [25] og BAL-væske [14]. Derudover er komplementfaktor C5a og dens receptor C5AR1 opreguleret i lungerne ved CARDS afhængig af sværhedsgrad [26] og spiller muligvis en afgørende rolle i at vedligeholde lungeinflammation med aktivering og rekruttering af myeloide celler samt aktivering af koagulationskaskaden [27]. Væsentlige patogenetiske faktorer er skitseret i Figur 1.
En af begrænsningerne ved de ovenstående beskrevne studier er, at det primært drejer sig om tværsnitssammenligninger af patienter med CARDS og raske. Således er især viden om, hvordan CARDS adskiller sig fra konventionel ARDS (både viral og nonviral), yderligere begrænset, og selvom betegnelser som »cytokinstorm« og »cytokinfrigivelsessyndrom« hyppigt anvendes i den videnskabelige litteratur, er forekomsten heraf ved CARDS tvivlsom og omdiskuteret [24]. Som eksempel på dette har man i større opgørelser fundet, at IL-6-niveauet i perifert blod generelt er lavere hos CARDS end hos patienter med non-COVID-19-ARDS [28]. I et ganske begrænset antal studier har man sammenlignet den lokale immunprofil ved CARDS og non-COVID-19-ARDS. I et nyligt publiceret arbejde undersøgte vi genekspression af en række cytokiner og kemokiner i immunceller fra BAL og fandt ingen forskel de to patientgrupper imellem [15]. I et lignende studie, der anvendte transkriptomanalyser af trakealaspirater, fandt man heller ikke højere ekspression af en lang række proinflammatoriske mediatorer ved CARDS end ved non-COVID-19-ARDS [29]. Til gengæld sås i begge studier, at en række andre gener var differentielt udtrykt hos patienter med CARDS, herunder opregulering af gener involveret i komplementaktivering samt en unik ekspression af IFN-stimulerede gener [15, 29].
Kun i ganske få studier har man beskæftiget sig med, hvordan immunmodulerende behandlinger såsom dexamethason og IL-6-receptorantagonister (RA), der aktuelt anvendes til behandling af CARDS, påvirker det lokale immunrespons i lungerne. Et nyligt enkeltcelle-transkriptomstudie på perifert blod fra patienter med COVID-19 viste, at dexamethason især var forbundet med ændring i neutrofile granulocytter med suppression af IFN-signalering og inducering af en mere immunsuppressiv profil i disse celler [30]. Lignende lungenære studier mangler foreløbigt. Vi har for nylig sammenlignet transkriptomprofiler i immunceller ophentet ved BAL fra patienter med CARDS med og uden dexamethasonbehandling og fandt her ingen forskelle i reguleringen af cytokiner og kemokiner, hvilket indikerer, at den primære effekt af dexamethason måske ikke involverer hæmning af en hyperinflammatorisk tilstand/cytokinstorm. Til gengæld så vi en differentiel ekspression af bl.a. IFN-stimulerede gener [15]. Således tegner der sig et mere komplekst billede af dexamethasons virkning, som det vil kræve yderligere lungenære studier at afdække i detaljer.
Som ved sepsis har forskellige farmakologiske behandlingsforsøg med immunologisk sigte ikke været forbundet med øget overlevelse af ARDS igennem de seneste årtier [4]. I skarp kontrast har flere kendte immunmodulerende behandlinger (dexamathason, IL-6-RA samt januskinase-1/2-inhibitorer) fundet ny anvendelse, idet man har påvist gavnlig effekt ved COVID-19, herunder til patienter med behov for respiratorbehandling. Studier af den lokale immunpatologi ved CARDS kan potentielt være med til at identificere nye angrebspunkter.
Baseret på ovenstående gennemgang er der især tre potentielle mekanismer, som vi mener, kan være interessante i den sammenhæng. IL-8 er et kemokin produceret af makrofager, der inducerer kemotaksi af primært neutrofile granulocytter og findes i høje koncentrationer i BAL-væske hos patienter med CARDS [14]. Neutrofile granulocytter udgør en væsentlig del af det innate forsvar mod COVID-19, men ser omvendt også ud til at kunne bidrage til de lokale komplikationer ved CARDS [6, 16, 22], hvorfor hæmning af neutrofil rekruttering til lungerne igennem et anti-IL-8-antistof kunne være gunstigt. Aktuelt er et enkelt fase 2-anti-IL-8-studie registreret på clinicaltrials.gov (NCT04347226). Et andet angrebspunkt kunne være checkpointhæmning med blokade af PD-1, hvilket f.eks. kan opnås med nivolumab og pembrolizumab, og som potentielt kan afbøde den udtalte udtrætning af T-celler i lungerne, som tilsyneladende er karakteristisk for CARDS, og som muligvis bidrager til yderligere lungeskade [14, 18]. På nuværende tidspunkt er der registreret fem fase 2-studier på clinicaltirals.gov for patienter med COVID-19 både med og uden cancer (NCT04413838, NCT04343144, NCT04356508, NCT04333914, NCT04335305). Endelig er behandling målrettet mod komplementsystemet af mulig værdi. Komplementaktivering ser ud til at være mere udtalt ved CARDS end ved konventionel ARDS [15], idet bl.a. C5a og dets receptor C5aR1 er opreguleret i lungerne hos patienter med CARDS [26], og anti-C5aR1-monoklonale antistoffer er påvist at reducere myeloid cellerekruttering til lungerne og forebygge lungeskade i en dyremodel [26].
To fase 2-studier med et anti-C5aR-antistof er registreret på clinicaltrials.gov (NCT04371367, NCT04333914). Det mekanistiske fundament for disse mulige behandlinger må dog fortsat siges at være særdeles begrænset og vil kræve yderligere basal og translationel forskning for at forstå.
Korrespondance Andreas Ronit. E-mail: andreas.ronit.01@regionh.dk
Antaget 26. april 2022
Publiceret på ugeskriftet.dk 6. juni 2022
Interessekonflikter ingen. Forfatternes ICMJE-formularer er tilgængelige sammen med artiklen på ugeskriftet.dk
Referencer findes i artiklen publiceret på ugeskriftet.dk
Artikelreference Ugeskr Læger 2022;184:V03220170
Andreas Ronit, Ronan M.G. Berg, Trine H. Mogensen, Ronni R. Plovsing
Ugeskr Læger 2022;184:V03220170
Mechanisms of COVID-19-induced lung injury involve complex immunopathological events which are currently being elucidated. Studying immune mechanisms at the primary site of injury, i.e. the lower airways, are particularly informative. This review provides a brief introduction to the methods used to perform sampling from the lungs of critically ill patients with COVID-19, key immunopathological findings and a discussion on how immunosuppressants may exert their effects locally.
Haase N, Plovsing R, Christensen S et al. Characteristics, interventions, and longer term outcomes of COVID-19 ICU patients in Denmark – a nationwide, observational study. Acta Anaesthesiol Scand. 2021;65(1):68-75.
Ashbaugh DG, Bigelow DB, Petty TL, Levine BE. Acute respiratory distress in adults. Lancet. 1967;2(7511):319-23.
ARDS Definition Task Force, Ranieri VM, Rubenfeld GD, Thompson BT, et al. Acute respiratory distress syndrome: the Berlin Definition. JAMA. 2012;307(23):2526-33.
Matthay MA, Zemans RL, Zimmerman GA et al. Acute respiratory distress syndrome. Nat Rev Dis Prim. 2019;5(1):18.
Wichmann D, Sperhake J-P, Lütgehetmann M et al. Autopsy findings and venous thromboembolism in patients With COVID-19: a prospective cohort study. Ann Intern Med. 2020;173(4):268-77.
Carsana L, Sonzogni A, Nasr A et al. Pulmonary post-mortem findings in a series of COVID-19 cases from northern Italy: a two-centre descriptive study. Lancet Infect Dis. 2020;20(10):1135-40.
Ackermann M, Verleden SE, Kuehnel M et al. Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in covid-19. N Engl J Med. 2020;383(2):120-8.
Nienhold R, Ciani Y, Koelzer VH et al. Two distinct immunopathological profiles in autopsy lungs of COVID-19. Nat Commun. 2020;11(1):5086.
Ehab A, Reissfelder F, Laufer J, Kempa AT. Transbronchial lung cryobiopsy performed in acute COVID-19 pneumonia: first report. Adv Respir Med. 2021;89(1):72-4.
Zhang H, Zhou P, Wei Y et al. Histopathologic changes and SARS-CoV-2 immunostaining in the lung of a patient with COVID-19. Ann Intern Med. 2020;172(9):629-32.
Wahidi MM, Lamb C, Murgu S et al. American association for bronchology and interventional pulmonology (AABIP) statement on the use of bronchoscopy and respiratory specimen collection in patients with suspected or confirmed COVID-19 infection. J Bronchology Interv Pulmonol. 2020;27(4):e52-4.
Torrego A, Pajares V, Fernández-Arias C et al. Bronchoscopy in patients with covid-19 with invasive mechanical ventilation: a single-center experience. Am J Respir Crit Care Med. 2020;202(2):284-7.
Gao CA, Bailey JI, Walter JM et al. Bronchoscopy on intubated covid-19 patients is associated with low infectious risk to operators. Ann Am Thora Soc. 2021;18(7):1243-6.
Ronit A, Berg RMG, Bay JT et al. Compartmental immunophenotyping in covid-19 ards: a case series. J Allergy Clin Immunol. 2021;147(1):81-91.
Fahnøe U, Ronit A, Berg RMG et al. A unique dexamethasone-dependent gene expression profile in the lungs of COVID-19 patients. medRxiv. Available at medRxiv: https://www.medrxiv.org/content/10.1101/2022.01.12.22269048v1 (preprint: 13. jan 2022).
Silvin A, Chapuis N, Dunsmore G et al. Elevated calprotectin and abnormal myeloid cell subsets discriminate severe from mild covid-19. Cell. 2020;182(6):1401-18.
Grant RA, Morales-Nebreda L, Markov NS et al. Circuits between infected macrophages and T cells in SARS-CoV-2 pneumonia. Nature. 2021;590(7847):635–41.
Saris A, Reijnders TDY, Nossent EJ et al. Distinct cellular immune profiles in the airways and blood of critically ill patients with covid-19. Thorax. 2021;76(10):1010-19.
Pandolfi L, Fossali T, Frangipane V et al. Broncho-alveolar inflammation in COVID-19 patients: a correlation with clinical outcome. BMC Pulm Med. 2020;20(1):301.
Arcanjo A, Logullo J, Menezes CCB et al. The emerging role of neutrophil extracellular traps in severe acute respiratory syndrome coronavirus 2 (covid-19). Sci Rep. 2020;10(1):19630.
Chua RL, Lukassen S, Trump S et al. Covid-19 severity correlates with airway epithelium-immune cell interactions identified by single-cell analysis. Nat Biotechnol. 2020;38(8):970-9.
Schulte-Schrepping J, Reusch N, Paclik D et al. Severe Covid-19 is marked by a dysregulated myeloid cell compartment. Cell. 2020;182(6):1419-40.e23.
Zhou Z, Ren L, Zhang L et al. Heightened innate immune responses in the respiratory tract of Covid-19 patients. Cell Host Microbe. 2020;27(6):883-90.e2.
Paludan SR, Mogensen TH. Innate immunological pathways in Covid-19 pathogenesis. Sci Immunol. 2022;7(67):eabm5505.
Blanco-Melo D, Nilsson-Payant BE, Liu W-C et al. Imbalanced host response to SARS-CoV-2 drives development of covid-19. Cell. 2020;181(5):1036-45.e9.
Carvelli J, Demaria O, Vély F et al. Association of covid-19 inflammation with activation of the C5a-C5aR1 axis. Nature. 2020;588(7836):146-50.
Afzali B, Noris M, Lambrecht BN, Kemper C. The state of complement in COVID-19. Nat Rev Immunol. 2022;22(2):77-84.
Sinha P, Matthay MA, Calfee CS. Is a “cytokine storm” relevant to Covid-19? JAMA Intern Med. 2020;180(9):1152-4.
Sarma A, Christenson SA, Byrne A et al. Tracheal aspirate RNA sequencing identifies distinct immunological features of Covid-19 ARDS. Nat Commun. 2021;12(1):5152.
Sinha S, Rosin NL, Arora R et al. Dexamethasone modulates immature neutrophils and interferon programming in severe Covid-19. Nat Med. 2022;28(1):201-11.