Maturity-onset diabetes of the young og graviditet

Anna Kauffmann1, Isabella Lindegaard Jørgensen1, Anne Cathrine Thuesen2, Lene Ringholm3, Tine Dalsgaard Clausen4, 5, Elisabeth Reinhardt Mathiesen3, 5, Torben Hansen2 & Peter Damm1, 5
Hovedbudskaber
Maturity-onset diabetes of the young (MODY) er en gruppe af monogene diabetesformer. Aktuelt er der beskrevet 14 forskellige undertyper, der alle skyldes funktionelle varianter i gener, som har betydning for funktionen og antallet af de pankreatiske betaceller [1]. Funktionelle varianter i glukokinase (GCK) (MODY 2), hepatocyte nuclear factor (HNF)1A (MODY 3) og HNF4A (MODY 1) udgør tilsammen 85% af MODY-tilfældene [1, 2]. Det skønnes, at 1-3% af alle personer med diabetes har MODY, men da diagnosen kun kan stilles ved en genetisk undersøgelse, er næsten 80% af MODY-tilfældene udiagnosticerede eller fejldiagnosticerede som type 1-diabetes, type 2-diabetes eller gestationel diabetes mellitus (GDM) [3, 4]. Kvinder med udiagnosticeret MODY vil ofte få diagnosen GDM under en graviditet. I et nyere dansk studie fandt man således, at knap 6% af kvinder med tidligere diætbehandlet GDM havde MODY-genvarianter [5].
MODY nedarves autosomal dominant, hvilket betyder, at et foster har 50% risiko for at arve MODY-genvarianten, hvis en af forældrene har MODY. I denne artikel fokuseres der på gravide med MODY og derfor kun på nedarvning af MODY fra maternel side.
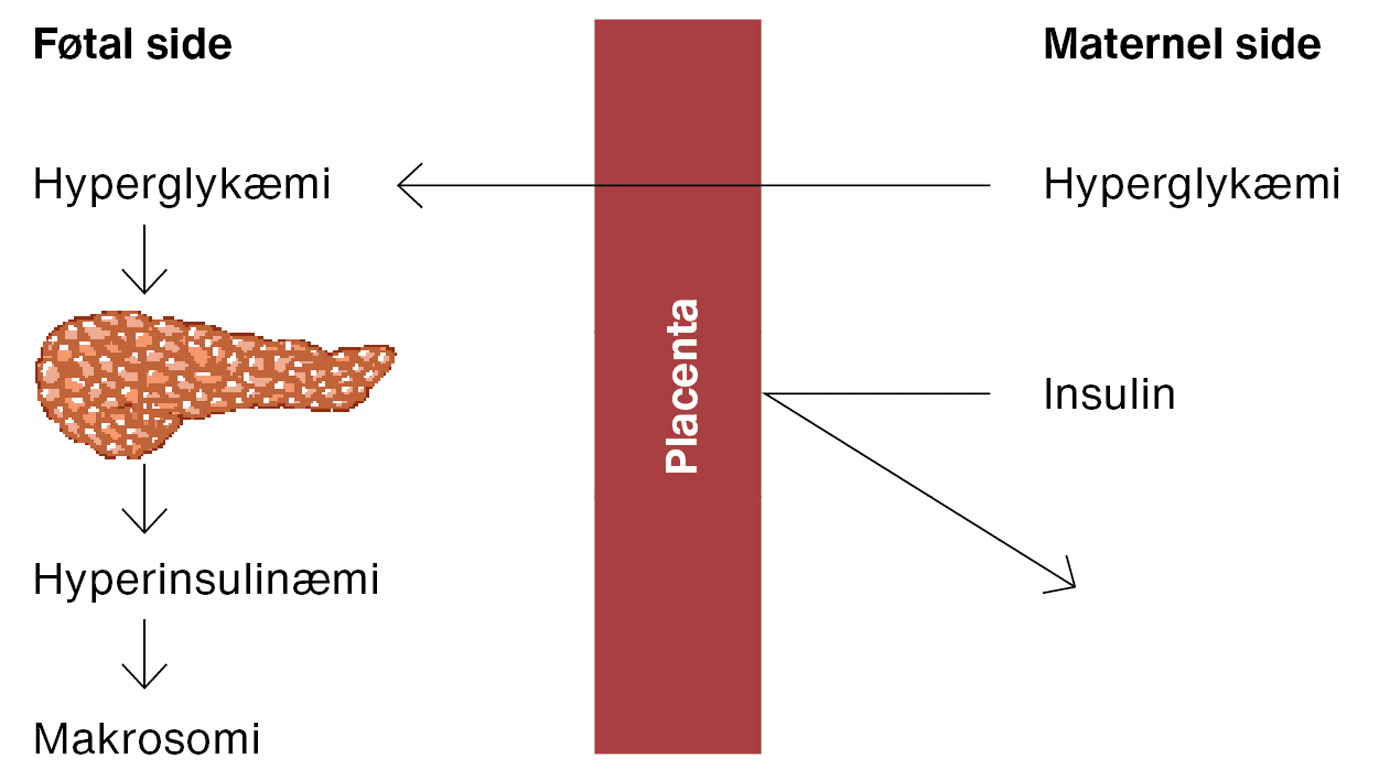
Alle typer diabetes er karakteriseret ved varierende grader af hyperglykæmi. Glukose er et lille molekyle, som mere eller mindre frit transporteres over placenta drevet af gradienten for glukose mellem den maternelle og den føtale side. Maternel hyperglykæmi medfører derfor føtal hyperglykæmi, som inducerer føtal hyperinsulinæmi og deponering af glukose og andre metabolitter i føtalt væv (specielt fedtvævet). Herved kan der opstå føtal overvækst også kaldet makrosomi (Pedersens hypotese (Figur 1)) [6]. Makrosomi, der ofte defineres som en fødselsvægt over 90-percentilen, justeret for gestationsalder og køn, er en af de hyppigste komplikationer hos gravide med diabetes [7]. Makrosomi er associeret med perinatale komplikationer, herunder en øget risiko for præterm fødsel, operativ forløsning, post partum-blødning, skulderdystoci og neonatal hypoglykæmi [7].
Ved maternel hyperglykæmi forårsaget af MODY er det derfor som ved andre diabetesformer afgørende at initiere behandling (diæt og evt. insulin), der kan normalisere blodglukoseniveauet så meget som muligt, så føtal makrosomi forebygges [8]. En udfordring er dog, at den føtale vækst også kan påvirkes af barnets (oftest ukendte) genotype, hvilket komplicerer behandlingen.
I denne artikel fokuseres på udkomme og behandling under graviditeten ved de tre hyppigste MODY-former: GCK-MODY, HNF1A-MODY og HNF4A-MODY (Tabel 1). I det følgende vil de tre varianter blive beskrevet efter hyppighed.
MODY 2 skyldes funktionelle varianter i genet, der koder for enzymet glukokinase (GCK). GCK fungerer som glukosesensor i betacellen, og genvarianter kan give anledning til en højere glukosetærskel for insulinsekretion i betacellerne, mens selve evnen til insulinsekretion er bevaret [9]. Fasteglukose er ofte let til moderat forhøjet (typisk 5,5-8,0 mmol/l), ligesom niveauet af HbA1c typisk vil være normalt eller let forhøjet (38-60 mmol/mol) [9]. Ved GCK-MODY ses der ikke et progredierende tab af betacellefunktionen i modsætning til de nedenfor nævnte MODY-typer. Ved GCK-MODY er der, fraset en let øget risiko for simplex retinopati, ingen øget risiko for mikro- og makrovaskulære forandringer i forhold til baggrundsbefolkningen [10]. Der er derfor som udgangspunkt intet behandlingsbehov uden for graviditeten.
Graviditetsudkomme og behandling af gravide med kendt maturity-onset diabetes of the young 2
Behandling af GCK-MODY under graviditeten er mere kompliceret end behandling hos ikkegravide, da den føtale vækst påvirkes af både den maternelle glykæmiske kontrol og fosterets GCK-genotype [11, 12]. Hvis fosteret har arvet moderens GCK-variant, vil det ligesom moderen have en forhøjet glukosetærskel for insulinsekretion og derfor ikke respondere med føtal hyperinsulinæmi og overvækst, når det udsættes for let til moderat hyperglykæmi, men i stedet vokse normalt intrauterint [11, 12]. Ud fra teoretiske overvejelser bør det maternelle blodglukoseniveau derfor ikke normaliseres, f.eks. med insulinbehandling, da dette kan øge risikoen for, at fosteret får suboptimale vækstbetingelser og dermed bliver relativt væksthæmmet [12, 13]. Hvis fosteret derimod ikke har arvet GCK-varianten, vil det, når det udsættes for maternel hyperglykæmi, være i øget risiko for makrosomi jf. Pedersens hypotese, og i disse tilfælde vil det derfor ofte være indiceret at forsøge at reducere moderens blodglukoseniveau. I overensstemmelse hermed har retrospektive studier vist, at børn, der ikke havde arvet moderens GCK-variant i gennemsnit vejede 550-700 g mere ved fødslen end børn, der havde arvet GCK-varianten [12-15].
Udfordringen ved graviditeter, som er kompliceret af GCK-MODY, er, at den føtale genotype ikke kendes. Derfor har nogle forfattere foreslået, at diabetesbehandlingen ikke bør intensiveres, f.eks. med insulinbehandling, medmindre regelmæssige UL-skanninger (f.eks. hver anden uge fra 26 uger) viser tegn på føtal overvækst, f.eks. ved et abdominalomfang > 75-percentilen som indikation på, at fosteret ikke har arvet GCK-varianten [12, 15-16]. Denne strategi har i studier vist sig effektiv hos gravide med GDM [17-19], dog uden at blive implementeret i de fleste GDM-behandlingsguidelines – mens der ikke foreligger evidens for effekten hos gravide med GCK-MODY. I flere retrospektive studier har man fundet, at der ikke var forskel i fødselsvægten hos børn, der ikke havde arvet GCK-varianten, uagtet om moderen havde været behandlet med insulin under graviditeten eller ej [12, 15, 20]. Endelig har man i et studie fundet, at farmakologisk behandling af ikkegravide med GCK-MODY ingen effekt havde på hyperglykæmien [21]. Det er derfor usikkert, hvad der er det optimale behandlingsregime i disse graviditeter [22].
HNF1A-MODY skyldes funktionelle varianter i HNF1A, som koder for en transkriptionsfaktor, der bl.a. udtrykkes i betacellen, og som er vigtig for regulering og ekspression af proteiner, der er involveret i glukosemetabolismen [9]. HNF4A-MODY skyldes funktionelle varianter i HNF4A, der koder for en transkriptionsfaktor, der er en regulator af HNF1A [23]. HNF1A- og HNF4A-MODY minder klinisk meget om hinanden og beskrives derfor samlet i denne artikel.
Funktionelle varianter i HNF1A og HNF4A kan føre til betacelledysfunktion resulterende i nedsat insulinrespons og postprandiel hyperglykæmi [9]. Personer med HNF1A- og HNF4A-MODY har samme øgede risiko for at udvikle mikro- og makrovaskulære komplikationer som personer med type 1- og type 2-diabetes [9, 23]. Der bør derfor stiles mod god glykæmisk kontrol svarende til anbefalingerne for type 1- og type 2-diabetes [2]. Førstevalgsbehandling er sulfonylurinstof, som virker ved at stimulere betacellerne til øget insulinudskillelse uden om de mekanismer, som HNF1A og HNF4A påvirker [23].
Graviditetsudkomme og behandling af gravide med kendt maturity-onset diabetes of the young 3
Hos gravide med HNF1A-MODY påvirkes fosterets vækst ikke af dets HNF1A-genotype, men i stedet af den maternelle glykæmiske kontrol [14, 24, 25]. I et retrospektivt studie fandt man, at det var relativt nemt at behandle den maternelle hyperglykæmi i disse graviditeter, og at børnenes fødselsvægt ikke var øget i forhold til baggrundsbefolkningens [14]. I Danmark anbefales der under graviditeten behandling med diæt og evt. insulin [2]. Sulfonylurinstof er kontraindiceret, fordi det passerer over placentabarrieren og i sig selv kan inducere føtal hyperinsulinæmi og deraf makrosomi og svær neonatal hypoglykæmi [26].
Desuden anbefales det som i andre graviditeter med diabetes at monitorere den føtale vækst med regelmæssige UL-skanninger (f.eks. med 4-6 ugers interval i tredje trimester).
Graviditetsudkomme og behandling af gravide med kendt maturity-onset diabetes of the young 1
Hos gravide med HNF4A-MODY påvirkes den føtale vækst af både den maternelle glykæmiske kontrol og fosterets HNF4A-genotype. I et studie fandt man, at børn, der havde arvet en funktionel HNF4A-variant, gennemsnitligt vejede ca. 800 g mere ved fødslen end søskende, der ikke havde arvet HNF4A-varianten [25]. 64% af de børn, der havde arvet HNF4A-varianten fra deres mor, og 46%, der havde arvet den fra deres far, var makrosome. På den baggrund konkluderede man, at både maternel hyperglykæmi og føtal HNF4A-genotype er risikofaktorer for udvikling af makrosomi [25]. Det er derfor vigtigt at stile mod god glykæmisk kontrol under graviditeten. Som ved HNF1A-MODY anbefales i Danmark behandling med diæt og evt. insulin under graviditeten samt monitorering af den føtale vækst med regelmæssige UL-skanninger [2]. Nyfødte med en HNF4A-variant har en særlig øget risiko for at udvikle neonatal hypoglykæmi, som kan være udtalt [25].
Som hos andre børn, der har været udsat for maternel hyperglykæmi, skal man være opmærksom på diagnostik og behandling af neonatal hypoglykæmi efter gældende guidelines [27]. Barnets MODY-genotype kan evt. undersøges på navlesnorsblod, hvis forældrene efter rådgivning ønsker dette.
Der findes relativt få studier, hvor man beskriver graviditetsudkomme hos kvinder med MODY-genvarianter. Studierne er primært retrospektive og inkluderer især kvinder, der først er diagnosticeret med MODY efter graviditeten. Det er på baggrund af disse få studier, at de nuværende behandlingsanbefalinger til gravide med kendt MODY er udarbejdet. Behandlingsanbefalingerne er ikke undersøgt i prospektive kohortestudier eller randomiserede kliniske studier hos gravide med kendt MODY. Den tilgængelige litteratur understreger dog, at graviditetsudkommet hos kvinder med MODY kan påvirkes af både den maternelle glykæmiske kontrol og fosterets genotype, der jo oftest ikke er kendt under graviditeten. Det kan derfor potentielt have stor betydning for behandlingen at kende den føtale MODY-genotype tidligt i graviditeten. Det er muligt at undersøge den føtale genotype tidligt i graviditeten med enten chorion villus-biopsi (moderkageprøve) eller amniocentese (fostervandsprøve), men da disse metoder er invasive med en lille risiko for efterfølgende abort, frarådes de til dette formål. I to mindre studier har man undersøgt, om cellefrit føtalt DNA i en maternel blodprøve kan anvendes til at genotypebestemme fostre hos gravide med MODY, og resultaterne er lovende [28, 29], så dette vil formentlig få praktisk anvendelse i en nær fremtid.
For at sikre den bedste monitorering og behandling af gravide med MODY bør diagnosen optimalt set være stillet før graviditeten, hvilket som tidligere beskrevet oftest ikke er tilfældet [5]. Personer med MODY vil ofte have en familiehistorie med flere diabetestilfælde [1, 2], selvom de novo-mutationer også forekommer. Der findes en række kliniske karakteristika hos personer med kendt diabetes, som gør, at genetisk udredning for MODY bør overvejes [2]. Kvinder med udiagnosticeret MODY vil ofte blive diagnosticeret med GDM ved screeningen omkring 24-28 graviditetsuger, fordi deres diabetes først opdages i forbindelse med graviditeten.
Der er foreslået forskellige kriterier for at identificere GCK-MODY blandt kvinder med GDM. Kombinationen af et fasteblodglukoseniveau på > 5,5 mmol/l og et BMI på < 25 kg/m2, er i en irsk population vist at have en 68% sensitivitet og 99% specificitet for GCK-MODY [30]. Baseret på disse kriterier skal der testes 2,7 kvinder med GDM for at diagnosticere én med GCK-MODY [30].
En anden måde at identificere kvinder med MODY blandt gravide, som er diagnosticeret med GDM, er at tilbyde alle genetisk undersøgelse for MODY. Det gøres ikke rutinemæssigt i dag, men undersøges aktuelt i et stort forskningsprojekt i Region Hovedstaden kaldet TRANSLATE (www.translate.ku.dk), hvor en prospektiv kohorte på 1.000 kvinder med GDM tilbydes genetisk undersøgelse for de tre nævnte MODY-former. Formålet er blandt andet at belyse, om genetisk undersøgelse for MODY-gener bør implementeres som en del af behandlingstilbuddet til gravide med GDM.
Korrespondance Peter Damm. E-mail: pdamm@dadlnet.dk
Antaget 28. marts 2023
Publiceret på ugeskriftet.dk 22. maj 2023
Interessekonflikter Der er anført potentielle interessekonflikter. Forfatternes ICMJE-formularer er tilgængelige sammen med artiklen på ugeskriftet.dk
Referencer findes i artiklen publiceret på ugeskriftet.dk
Artikelreference Ugeskr Læger 2023;185:V02230067
Anna Kauffmann, Isabella Lindegaard Jørgensen, Anne Cathrine Thuesen, Lene Ringholm, Tine Dalsgaard Clausen, Elisabeth Reinhardt Mathiesen, Torben Hansen & Peter Damm
Ugeskr Læger 2023;185:V02230067
Maturity-onset diabetes of the young (MODY) is a group of hereditary monogenetic forms of diabetes. MODY accounts for 1-3% of all persons with diabetes but is often undiagnosed or misdiagnosed as type 1 diabetes, type 2 diabetes, or gestational diabetes. Diagnosing MODY is essential, as the most optimal treatment both during and outside of pregnancy depends on the MODY type. This review focuses on the outcome and treatment of the three most common types of MODY during pregnancy.