Ny viden om prognose for og behandling af børneabsenceepilepsi

Joakim Bloch1 & Maria J. Miranda2
Børneabsenceepilepsi (BAE) udgør ca. 10% af epilepsiformerne hos børn [1]. BAE er karakteriseret ved hyppige absencer, dvs. korte episoder med bevidsthedspåvirkning og evt. motoriske automatismer. Absencer forekommer også ved andre epilepsisyndromer, bl.a. juvenil absenceepilepsi. BAE starter oftest i 5-7-års alderen og er typisk selvremitterende inden for få år [2]. I visse tilfælde udvikler den sig til juvenil myoklon epilepsi med absencer, myoklonier og generaliserede tonisk-kloniske anfald (GTK) [2]. Selvom man længe har anset BAE for at være en benign sygdom, er der i de seneste år kommet fokus på potentielt alvorlige kognitive komorbiditeter. Samtidig er der tilkommet ny forskning af høj evidens om behandlingsvalg. Formålet med denne artikel er at gennemgå den aktuelle viden om behandling og kognitive komorbiditeter ved BAE.
Den først kendte omtale af absencer, eller petit mal, som anfaldene først kaldtes, stammer fra 1770 [3] og beskriver en ung pige, der i en alder af syv år fik fjernhedstilfælde og siden generaliserede anfald. De følgende år var der beskrivelser af absencer, men man havde en uklar skelnen mellem absencer, fokale komplekse anfald og atoniske anfald. I starten af det 20. århundrede talte man om et syndrom, pyknolepsi, der er karakteriseret ved disse anfald, og som kan fremkaldes ved hyperventilation. I 1930’erne, hvor elektroencefalografi (EEG) begyndte at vinde frem, kom man et skridt længere ved opdagelsen af de klassiske 3-4 Hz-spike-wave (SW)-forandringer, men den nuværende definition af BAE som epileptisk syndrom vandt først frem i løbet af 1980’erne [3].
Absencer klassificeres som generaliserede epileptiske anfald, og BAE betegnes i praksis stadig som en idiopatisk generaliseret epilepsi eller en genetisk epilepsi. Symptomerne på BAE er hyppige anfald af absencer, hos nogle op imod 100 dagligt [1, 2]. Absencerne varer typisk kun 4-20 s (sjældent over 30 s) og karakteriseres ved, at børnene pludselig ophører med aktivitet, stirrer frem for sig og bliver ukontaktbare [1, 2]. Der kan være samtidige automatismer, dvs. stereotype bevægelser, og milde kloniske komponenter, ofte i form af øjenmyoklonier [4] om end det er diskuteret, i hvilken grad dette forekommer ved klassisk BAE [3]. Det ses, at børnene fortsætter enkle igangværende aktiviteter under anfald og også reagerer på eksterne stimuli ved f.eks.
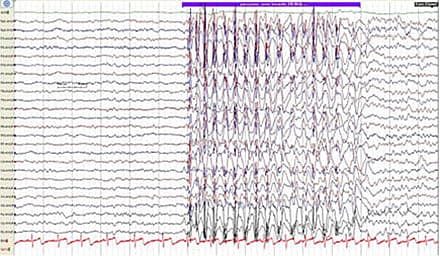
at dreje hovedet mod en stemme [4-6]. Efter anfaldet fortsætter de deres aktivitet og har ofte ikke selv bemærket noget. Under anfaldene er der bevidsthedspåvirkning, men det er uklart, præcist i hvilken grad bevidstheden er svækket. Der er typisk amnesi for anfaldene [7]. Absencer kan fremprovokeres af bl.a. søvnmangel, lys og hyperventilation [5]. Under absencer forekommer der generaliserede SW-EEG-forandringer med en frekvens på 3-4 Hz [8, 9]. Disse er karakteristiske og er en del af diagnosen BAE, men forekommer også ved absencer associeret med andre syndromer,
f.eks. juvenil absenceepilepsi og juvenil myoklon epilepsi [8]. Det interiktale EEG i BAE viser stort set altid forandringer i form af 3-4 Hz SW-paroksysmer, enten spontant eller provokeret særligt ved hyperventilation [9]. Differentialdiagnoser til BAE er bl.a. narkolepsi,
fokale komplekse anfald med fjernhed, psykogene nonepileptiske anfald og attention deficit and hyperkinetic disorder (ADHD).
Nyere forskning tyder på, at absencer skyldes oscillerende aktivitet mellem thalamus og cortex cerebri pga. epileptisk aktivitet i det talamiske søvnkredsløb. SW-komplekserne svarer ifølge den tese til sleep spindles, som ses i non-REM-søvnen hos raske. Det er også observeret, at den epileptiske aktivitet kan kobles til grader af arousal inden for det vågne spektrum. Absencetilstanden kan dog ikke sammenlignes med søvn. Man kan ikke vækkes fra en absence, og den motoriske inhibition, der ses under absenceanfald, er ikke til stede
under non-REM-søvn [10]. Der er påvist et komplekst genetisk element, som bl.a. involverer mutationer i gamma-aminobutansyrereceptorer og calciumkanaler. Mutationerne er kun påvist i få, mindre populationer, og der er påvist forskelle på tværs af etnicitet [11]. Yderligere skal man i tilfælde med tidlig debut (< 4 år) og manglende respons på medicinsk behandling overveje glukosetransporter-1-mangel som årsag. Behandlingen er i så fald ketogen diæt [12]. Vi har endnu ingen klar forståelse af genetikken bag syndromet.
I mange år har evidensen været så mangelfuld, at man ikke har kunnet udtale sig sikkert om effektivitet, tolerans og prognose ved de tre anbefalede lægemidler til behandling af BAE: lamotrigin (LTG), valproat (VPA) og ethosuximid (ESM) [13] (Tabel 1). The Childhood Absence Epilepsy Study (CAES) er et nyere amerikansk randomiseret klinisk studie, hvor man følger en kohorte på 446 børn med BAE [18]. Det er det første studie inden for BAE, der følger International League Against Epilepsy-kriterierne for klasse 1-evidens [15].
I studiet bliver børn med BAE randomiseret til behandling med enten LTG, ESM eller VPA. Det primære behandlingsmål er behandlingssucces (i studiet kaldet freedom from treatment failure), altså at man er anfaldsfri og ikke er ophørt med behandling pga. svære bivirkninger. Det sekundære behandlingsmål er færre opmærksomhedsforstyrrelser målt via Conners’ continous performance score [18]. Efter 16-20 uger oplevede 58% i CAES behandlingssucces på VPA, 53% på ESM og 29% på LTG. Forskellen i behandlingssucces på VPA og ESM var ikke signifikant, men der var signifikant flere, der udviste opmærksomhedsforstyrrelser under behandling med VPA (43%) end under behandling med ESM (33%) og LTG (24%). I alle grupper var der ingen forskel i opmærksomhedsforstyrrelser mellem de anfaldsfri og dem, der fortsat havde anfald [18]. Efter et år var det stadig VPA og ESM, der gav behandlingssucces hos de fleste, stadig uden en signifikant forskel de to medikamenter imellem. Alligevel havde over 50% af dem, der initialt var blevet randomiseret til disse to medikamenter, ikke oplevet behandlingssucces efter et år [15]. Det lave tal kan skyldes, at CAES er lavet efter et intention to treat-princip, og at mange af dem, der kunne være blevet anfaldsfri på medicinen er ophørt med den pga. bivirkninger (jf. definitionen af freedom from treatment failure). At inkludere både anfaldsfrihed og tolerans ser vi som en relevant måde at undersøge medikamenter på hos denne patientgruppe, hvor nonkomplians pga. bivirkninger er en væsentlig faktor.
Under alle omstændigheder er det vigtig viden for klinikeren, at det kun i omkring halvdelen af tilfældene er det første medikament, der giver behandlingssucces.
CAES viser også, at signifikant flere af dem, der var randomiseret til VPA, efter et år var ophørt pga. intolerable bivirkninger. Vægtøgning blev rapporteret hyppigere som bivirkning og årsag til behandlingsstop i VPA-gruppen end i de øvrige to grupper. Det blev desuden via test påvist, at der ved behandling med VPA stadig var flere opmærksomhedsforstyrrelser, selv blandt de børn der initialt havde normale kognitive test [15].
CAES peger med høj evidens på, at ESM er det bedst tålte og et af de mest effektive medikamenter mod BAE på både kort og lidt længere sigt. Det er i anden litteratur foreslået, at ESM kan have en sygdomsmodificerende effekt [16]. Sammen med en generelt god bivirkningsprofil kan dette være årsag til de gode kognitive resultater efter behandling med ESM.
ESM er i andre studier også påvist at være det medikament, der giver de fleste patienter anfaldsfrihed efter fem og ti år [16], og det er i et retrospektivt studie påvist, at dets virkning indsætter tidligere end virkningen af LTG og VPA [17]. ESM kan dog give gastrointestinale bivirkninger og udslæt [15]. Den individuelle behandling skal altid tilpasses bivirkninger og behandlingsrespons. ESM virker desuden, uanset syndrom, ikke på GTK, som nogle BAE-patienter udvikler [19].
Af andre antiepileptika, man har forsøgt, kan nævnes levetiracetam. Dette er dog påvist kun at have en mindre effekt på BAE [20].
Der er i de senere år kommet fokus på potentielt alvorlige kognitive komorbiditeter ved BAE. I CAES har man fundet, at 36% af børnene udviser opmærksomhedsforstyrrelser inden behandlingsstart, fire gange så mange som i baggrundsbefolkningen. Dette på trods af, at børnene har en intelligenskvotient, der ligger inden for normalområdet, og ikke har større neurokognitive deficit. Problemerne overses ofte af forældrene, idet manglen på opmærksomhed ikke forekommer samtidig med hyperaktivitet. Disse problemer bliver dog hos mange patienter ikke bedre på trods af anfaldsfrihed under behandlingen [21]. Samme studie har vist, at patienter, der har med længere anfald (≥ 20 s), laver flere fejl i visse neuropsykologiske test, men det er uklart, om denne sammenhæng skyldes en sværere interiktal kognitiv forstyrrelse, eller om det skyldes, at fejlene forekommer under anfaldene [22]. I et andet studie har man fundet, at børn med absenceepilepsi i sammenligning med raske søskende udviser flere kognitive komorbiditeter end børn med andre epilepsiformer. [23]. Data tyder på, at manglende behandlingsrespons forværrer den kognitive prognose, men det er uklart, om der er tale om en mere
alvorlig fænotype, der både responderer dårligt på behandling og har dårligere kognition [24]. Sammen med andre studier, hvor man også påviser væsentlige kognitive komorbiditeter [25] og endda nedsat volumen af temporallapperne hos patienterne [26], tyder dette på, at man skal revurdere sit billede af BAE som en helt benign epilepsiform med hensyn til komorbiditet.
Inden for den tilgængelige forskning om langtidsprognosen ved BAE er der stor forskel på studiernes metoder angående bl.a. inklusionskriterier og længde af opfølgning. Der er altså stadig ikke afklaring om prognosen [9]. Det står dog klart, at langt de fleste bliver anfaldsfri omkring 12-års alderen og kan trappe ud af behandling, mens nogle progredierer til juvenil myoklon epilepsi [2].
I CAES fik 12% i løbet af syv år GTK [27]. Som det også er påvist i andre studier [14], er mangel på behandlingsrespons ved førstevalgsbehandling en dårlig prognostisk faktor [27]. I visse studier angives der væsentligt højere rater af GTK, men dette kan skyldes længere opfølgning, da GTK typisk forekommer senere i sygdomsforløbet. Respons på ESM er et godt prognostisk tegn, da kun få af de patienter, som bliver behandlet med ESM, senere får GTK [27]. Det skyldes måske, at en subtype af BAE med høj risiko for GTK ikke responderer på ESM, eller måske skyldes det ESM’s formodede sygdomsmodificerende effekt [16].
Patienter med BAE er udsat for både sygdomsbetingede kognitive deficit [15, 21] og kognitive bivirkninger af antiepileptisk medicin [28] (Tabel 2). Dette kalder på fokus på børnenes psykosociale udvikling og uddannelsesmæssige formåen. Et studie fra 1997 viste dårligere prognose for patienter med BAE end for patienter med juvenil reumatoid artritis mht. bl.a. uddannelse og risiko for udvikling af misbrug [29]. Der er dog for lidt viden på området og alt for store forskelle studierne imellem, specielt hvad angår inklusionskriterierne [9, 30]. Det har stor betydning, om man f.eks. ekskluderer patienter med øjenmyoklonier, patienter med et for BAE ikke klassisk EEG og patienter med GTK.
I disse år sker der væsentlige fremskridt inden for forskningen i BAE. ESM er det bedste førstevalg til behandling af klassisk BAE, da dette medikament giver bedst anfaldsfrihed, har den bedste prognose, hvad angår kognition, og muligvis har en sygdomsmodificerende effekt. Hos nogle patienter, der ikke responderer på ESM, findes VPA eller LTG fortsat som behandlingsmuligheder. Hos patienter med BAE, der ikke responderer på behandling med ESM, er der desuden højere risiko for udvikling af generaliserede anfald og progression til juvenil myoklon epilepsi. Vi ved ikke nok om langtidsprognose og specielt psykosocial udvikling hos disse børn, og det kunne være nærliggende at undersøge, om de har brug for ekstra opmærksomhed i uddannelsessystemet. En bedre behandling af børn med BAE, hvor man inddrager den nyeste evidens på området, vil føre til færre kognitive udfordringer og muligvis bedre uddannelsesmæssige chancer og levestandard for denne store gruppe patienter.
Korrespondance: Joakim Bloch. E-mail: blochjoakim@gmail.com
Antaget: 8. februar 2017
Publiceret på Ugeskriftet.dk: 27. marts 2017
Interessekonflikter:
Taksigelser: Krisztina Benedek, Neurofysiologisk Afdeling, Rigshospitalet Glostrup takkes for lån af spike-wave-EKG og for video af patient.
Tak til mor og barn for tilladelse til at bruge video.
Until now, ethosuximide (ESM), sodium valproate (VPA) and lamotrigine have been considered the drugs of choice in the management of childhood absence epilepsy, and there has been no high-validated evidence to distinguish their effects. New research shows, however, that while VPA and ESM are equally effective, ESM is the best tolerated of the two drugs, when considering cognitive adverse effects. This is of major importance, as cognitive comorbidities can be dire in childhood absence epilepsy, possibly affecting the psychosocial prognosis of the patients. More research is needed in this area.
Caraballo RH, Dalla B. Pediatric neurology Part I. I Dulac ML, Sarnat HB, red. Handbook of clinical neurology. Vol. 111 (3rd series). Elsevier, 2013.
Guerrini R. Epilepsy in children. Lancet 2006;367:499-524.
Bureau M, Genton P, Dravet C et al. Current problems in epilepsy: epileptic syndromes in infancy, childhood and adolescence. John Libbey Eurotext 2012:278-91.
Penry JK, Porter RJ, Dreifuss RE. Simultaneous recording of absence seizures with video tape and electroencephalography. Brain 1975;98:
427-40.
Sadleir LG, Scheffer IE, Smith S et al. Automatisms in absence seizures in children with idiopathic generalized epilepsy. Arch Neurol 2009;66:
729-34.
Berman R, Negishi M, Vestal M et al. Simultaneous EEG, fMRI, and behavior in typical childhood absence seizures. Epilepsia 2010;51:2011-22.
Bayne T. The presence of consciousness in absence seizures. Behav Neurol 2011;24:47-53.
Sadleir LG, Scheffer IE, Smith S et al. EEG features of absence seizures in idiopathic generalized epilepsy: impact of syndrome, age, and state. Epilepsia 2009;50:1572-8.
Matricardi S, Verrotti A, Chiarelli F et al. Current advances in childhood absence epilepsy. Pediatr Neurol 2014;50:205-12.
Halász P. Are absence epilepsy and nocturnal frontal lobe epilepsy system epilepsies of the sleep/wake system? Behav Neurol 2015;
2015:231676.
Yalcin O. Genes and molecular mechanisms involved in the epileptogenesis of idiopathic absence epilepsies. Seizure 2012;21:79-86.
Thouin A, Crompton DE. Glut1 deficiency syndrome: absence epilepsy and la soupe du jour. Pract Neurol 2016;16:50-2.
Posner EB, Mohamed K, Marson AG. Ethosuximide, sodium valproate or lamotrigine for absence seizures in children and adolescents. Cochrane Database Syst Rev 2005;4:CD003032.
Wirrell E, Camfield C, Comfield P et al. Prognostic significance of failure of the initial antiepileptic drug in children with absence epilepsy. Epilepsia 2001;42:760-3.
Glauser TA, Cnaan A, Shinnar S et al. Ethosuximide, valproic acid, and lamotrigine in childhood absence epilepsy: initial monotherapy outcomes at 12 months. Epilepsia 2013;54:141-55.
Berg AT, Levy SR, Testa FM et al. Long-term seizure remission in childhood absence epilepsy: might initial treatment matter? Epilepsia 2014;55:551-7.
Hwang H, Kim H, Kim SH et al. Long-term effectiveness of ethosuximide, valproic acid, and lamotrigine in childhood absence epilepsy. Brain Dev 2012;34:344-8.
Glauser TA, Cnaan A, Shinnar S et al. Ethosuximide, valproic acid, and lamotrigine in childhood absence epilepsy. N Engl J Med 2010;362:
790-9.
Schmitt B, Kovacevic-Preradovic T, Critelli H et al. Is ethosuximide a risk factor for generalised tonic-clonic seizures in absence epilepsy? Neuropediatrics 2007;38:83-7.
Fattore C, Boniver C, Capovilla G et al. A multicenter, randomized, placebo-controlled trial of levetiracetam in children and adolescents with newly diagnosed absence epilepsy. Epilepsia 2011;52:802-9.
Masur D, Shinnar S, Cnaan A et al. Pretreatment cognitive deficits and treatment effects on attention in childhood absence epilepsy.
Neurology 2013;81:1572-80.
Dlugos D, Shinnar S, Cnaan A et al. Pretreatment EEG in childhood absence epilepsy: associations with attention and treatment outcome. Neurology 2013;81:150-6.
Fastenau PS, Johnson CS, Perkins SM et al., Neuropsychological status at seizure onset in children: risk factors for early cognitive deficits. Neurology 2009:73:526-34.
Franzoni E, Matricardi S, Di Pisa V et al., Refractory absence seizures: An Italian multicenter retrospective study. Eur J Paediatr Neurol 2015;
19:660-4.
Caplan R, Siddarth P, Stahl L et al. Childhood absence epilepsy: behavioral, cognitive, and linguistic comorbidities. Epilepsia 2008;49:1838-46.
Caplan R, Levitt J, Siddarth P et al. Frontal and temporal volumes in Childhood Absence Epilepsy. Epilepsia 2009;50:2466-72.
Shinnar S, Cnaan A, Hu F et al. Long-term outcomes of generalized tonic-clonic seizures in a childhood absence epilepsy trial. Neurology 2015;85:1108-14.
Loring DW, Marino S, Meador KJ. Neuropsychological and behavioral effects of antiepilepsy drugs. Neuropsychol Rev 2007;17:413-25.
Wirrell EC, Camfield CS, Camfield PR et al. Long-term psychosocial outcome in typical absence epilepsy. Sometimes a wolf in sheeps‘ clothing. Arch Pediatr Adolesc Med 1997;151:152-8.
Seneviratne U, Cook M, D‘Souza W. The prognosis of idiopathic generalized epilepsy. Epilepsia 2012;53:2079-90.