Paraneoplastiske neurologiske syndromer

Anna Christine Nilsson1, 2, Matias Ryding2, 3, Charlotte Aaberg Poulsen4 & Morten Blaabjerg2, 3, 4
Hovedbudskaber
Paraneoplastiske neurologiske syndromer (PNS) er indirekte, immunmedierede effekter af cancer, som afficerer nervesystemet [1]. Det er autoimmune syndromer, som menes at opstå, når et immunologisk respons er rettet mod et autoantigen, som findes ektopisk udtrykt i en tumor, men samtidig er normalt udtrykt i nervesystemet. PNS rammer ~ 1:300 patienter med cancer, men incidensen er 1/100.000 personår, hvilket tyder på, at syndromerne fortsat er underdiagnosticerede [2]. Incidensen er dog stigende over tid, formentlig pga. øget kendskab til diagnoserne og forbedret diagnostik. Den kliniske præsentation varierer, men er genkendelig inden for subtyper af PNS.
Rettidig diagnosticering forudsætter viden om den kliniske, immunologiske og onkologiske heterogenitet. PNS kan være en vanskelig diagnose og kræver udelukkelse af cancer i nervesystemet (metastaser, meningeal karcinomatose) samt indirekte påvirkning som følge af koagulopati, behandlingsrelateret neurotoksicitet, metaboliske forstyrrelser eller infektion. Diagnosen understøttes af specifikke antineurale antistoffer, som kan påvises i serum og/eller cerebrospinalvæske (CSV). Viden om analyserne og begrænsningerne ved antistoftestning er afgørende for at sikre korrekt fortolkning. De diagnostiske kriterier for PNS fra 2004 var delvist forældede pga. fremskridt på området [3], hvilket har medført en redefinering af de diagnostiske kriterier for PNS i 2021, herunder PNS-Care-score til vurdering af risiko for PNS [4]. Her præsenterer vi de opdaterede diagnostiske kriterier for PNS i en dansk kontekst..
Den tidligere anvendte terminologi på området er ikke retvisende. PNS ses ikke kun i relation til de tidligere, såkaldte onkoneurale antistoffer, hvor patomekanismerne er primært T-cellemedierede, men også ved de primært B-cellemedierede syndromer. Derfor er begreberne ændret, således at PNS nu inddeles efter både neurologisk fænotype og typen af neuralt autoantistof. I de opdaterede diagnostiske kriterier opdeler man PNS i kliniske neurologiske fænotyper af høj- og intermediærrisiko [4]. De lidelser, som nu klassificeres som højrisiko, blev tidligere benævnt »klassiske« PNS og omfatter encefalomyelitis [3], limbisk encefalitis [5], hurtigt progredierende cerebellart syndrom [6], opsoklonus-myoklonus-syndrom [7], sensorisk neuronopati [8], enterisk neuropati (gastrointestinal pseudoobstruktion) [9] og Lambert-Eatons myastent syndrom [10] (Tabel 1). Fælles for disse kliniske fænotyper er, at cancer er en vigtig, udløsende faktor, og derfor skal patienterne altid udredes for en underliggende cancer.
I intermediærrisikogruppen kan de neurologiske syndromer forekomme både med og uden underliggende cancer. PNS skal især overvejes, hvis symptomerne progredierer hurtigt, eller hvis der er tegn til inflammation i CSV (pleocytose, forhøjet proteinniveau, eventuelt forhøjet IgG-indeks og oligoklonale bånd) eller ved MR-skanning af centralnervesystemet [4]. Autoimmun encefalitis er ofte en intermediærrisikofænotype, men risikoen for underliggende cancer er afhængig af det påviste autoantistof (Tabel 1). Et eksempel er anti-N-methyl-D-aspartat-receptor (NMDAR)-encefalitis, hvor forekomsten af underliggende tumor er afhængig af alder og køn [11]. Andre neurologiske fænotyper i intermediærrisikogruppen er hjernestammeencefalitis [12], isoleret myelopati [13], polyradikulitis [14, 15], stiff person syndrome [16, 17] og Morvans syndrom [18] (Tabel 1).
Neurale autoantistoffer er vigtige for at målrette udredningen for en underliggende cancer. Begrebet paraneoplastiske eller onkoneurale antistoffer anvendes ikke i de opdaterede diagnostiske kriterier, men er erstattet af højrisikoantistoffer (> 70% association til cancer) og intermediærrisikoantistoffer (30-70% association til cancer). Dertil kommer lavrisikoantistoffer (< 30% association til cancer) [4]. Med denne inddeling er der ikke taget hensyn til en eventuel patogen effekt. En oversigt over antistoffers association med underliggende cancer og neurologisk fænotype kan ses i Tabel 2.
De fleste højrisikoantistoffer er rettet mod intracellulære, neurale antigener, hvilket betyder, at antistofferne med enkelte undtagelser ikke er direkte patogene. I stedet er patomekanismen cytotoksisk, T-cellemedieret, neural celledestruktion, hvilket medfører en dårligere neurologisk prognose. Det enkelte antistof er relateret til en eller flere specifikke neurologiske fænotyper og til en eller flere former for cancer. Derfor er antistofferne gode biomarkører for PNS.
Ved B-cellemedieret PNS er antistofferne rettet mod antigener i celleoverfladen eller i synapser, og her har antistofferne et klart patogent potentiale ved direkte påvirkning af målantigenet (internalisering, aktivering af komplementsystemet eller funktionelle modifikationer). Fjernelse af antistofferne medfører således i reglen bedring af de neurologiske symptomer. Frekvensen af en underliggende cancer varierer dog væsentligt, afhængig af hvilket neuralt antigen antistofferne er rettet mod, og er også relateret til patientens køn og alder. For eksempel er anti-NMDAR-antistoffer associeret til teratom hos unge kvinder, men hos små børn og unge mænd er anti-NMDAR sjældent relateret til cancer [11, 19].
For at stille diagnosen PNS kræves, at man har udelukket relevante differentialdiagnoser, hvoraf mange er hyppigere forekommende end PNS. Den initiale udredning er derfor, med rette, ofte bred. Hvis mistanken om PNS er bestyrket, kan kombinationen af klinisk fænotype, antistof, tilstedeværelse eller fravær af cancer og opfølgningsperiode anvendes til beregning af PNS-Care-score [4], som kan sandsynliggøre forekomsten af PNS (Tabel 3).
Ved PNS skal patienten undersøges for underliggende cancer på diagnosetidspunktet. Hos 65% af patienter med PNS forekommer det neurologiske syndrom, inden en cancer er diagnosticeret [20]. Udredningen guides af den kliniske fænotype og de påviste antistoffer. Dette gøres i reglen med CT af thorax og abdomen eller helkrops FDG-PET-CT, undertiden i kombination med målrettet billeddiagnostik eller paraklinik afhængig af den formodede cancerassociation [21]. Et eksempel er UL-skanning af testes hos en patient med limbisk encefalitis eller hjernestammeencefalitis og påvist anti-Ma2-antistof. Hvis der ikke kan påvises cancer ved den initiale screening, bør udredningen gentages hver 4.-6. måned i to år hos patienter med neurologiske fænotyper af højrisiko og med højrisikoantistoffer samt ved højrisikofænotyper og intermediærrisikoantistof, hvis patienterne samtidig har andre risikofaktorer som for eksempel høj alder eller rygning, eller hvis der er samtidig forekomst af flere antistoffer [4]. De cancertyper, som oftest er associeret til PNS, er småcellet lungecancer, brystcancer, ovariecancer, ikkesmåcellet lungecancer og lymfom. Hvis der er påvist et lavrisikoantistof, vil cancerudredning ved debuttidspunktet i reglen være sufficient.
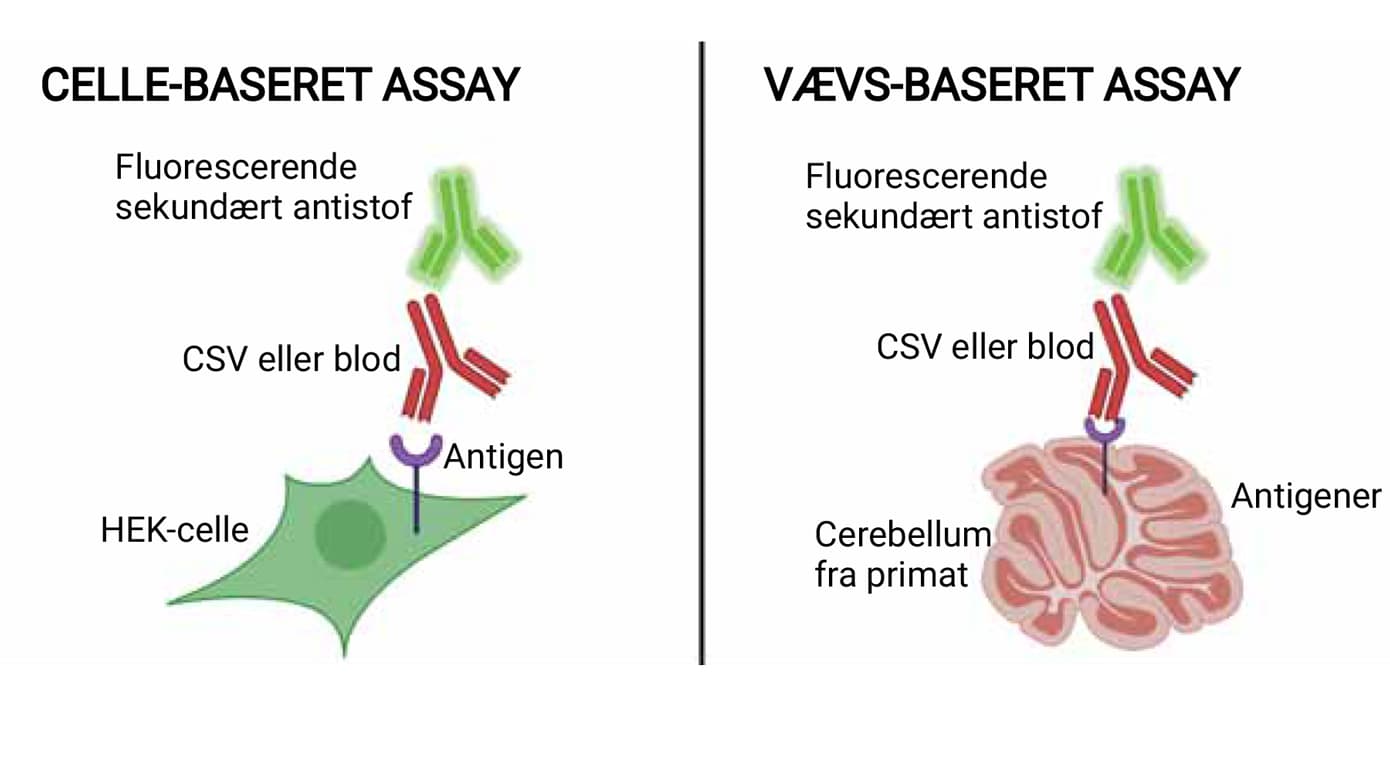
Den gyldne standardmetode for detektion af neurale autoantistoffer er vævsbaseret indirekte immunfluorescens i kombination med enten line immunoassay med rekombinante antigener for autoantistoffer rettet mod intracellulære antigener, eller indirekte immunfluorescens med antigentransfekterede human embryonal nyre (HEK)-293-celler som substrat (cellebaseret assay, CBA) for autoantistoffer rettet mod celleoverflade eller synaptiske antigener [4]. I Danmark anvendes cerebellum fra abe som standardsubstrat til den vævsbaserede metode (Figur 1). Fordelen ved at anvende en vævsbaseret metode er, at der kan undersøges for flere autoantistoffer end ved line immunoassay eller CBA, og at antigenernes native konformation er bevaret i højere grad. Ved at anvende en vævsbaseret metode er det også muligt at teste for nye autoantistoffer, som der endnu ikke findes specifikke kommercielle test for. Man skal dog være opmærksom på, at ikke alle autoantistoffer kan påvises ved indirekte immunfluorescens på abecerebellum, selvom det er en screeningsmetode. Det gælder for anti-voltage-gated calcium channel og antiglycinreceptorantistoffer, og det er uafklaret, om de vævsbaserede metoder kan anvendes til at påvise anti-SOX1.
Sensitivitet og specificitet i CSV og serum varierer mellem antistofferne, hvorfor man bør teste begge prøvematerialer [5]. Som eksempel kan nævnes, at anti-NMDAR-antistoffer i CSV er højspecifikke for anti-NMDAR-encefalitis, og typisk betragtes anti-NMDAR-antistoffer som obligatoriske for at kunne stille diagnosen. Hvis man kun tester serum, risikerer man at overse diagnosen, da anti-NMDAR-antistoffer ikke kan påvises i serum hos ~ 15% af patienterne [22]. Det omvendte gør sig gældende ved anti-leucine-rich glioma-inactivated 1 (LGI1)- [23] og ved anti-contactin-associated protein-like 2 (Caspr2)-medieret sygdom, hvor csv kan være negativ [24].
Der er risiko for både falsk positive og falsk negative resultater ved det anvendte line immunoassay, der som tidligere nævnt er baseret på rekombinante antigener, hvor antigenets struktur er ændret i forhold til in vivo. Man bør være særligt påpasselig, hvis autoantistoffet kun kan påvises ved line immunoassay og ikke kan detekteres ved indirekte immunfluorescens med abecerebellum som substrat [25]. Hvis et påvist neuralt antistof tilsyneladende ikke kan tillægges relevans i en given klinisk kontekst, bør man være opmærksom på falsk positive eller uspecifikke reaktioner og tage kontakt til laboratoriet med henblik på videre udredning. Falsk positive resultater kan føre til unødvendig udredning for cancer, bekymring hos patienten og i værste fald uhensigtsmæssig behandling. Den positive prædiktive værdi kan være så lav som 39%, især hvis antistoffet kun kan påvises ved line immunoassay [26].
Udviklingen går stærkt på området, og kendskab til begrænsningerne ved autoimmun diagnostik af PNS er afgørende for korrekt udredning og fortolkning. Ikke alle analyser er kommercielt tilgængelige, men kan rekvireres som forsknings- og udviklingsanalyser efter kontakt til Autoimmunlaboratoriet, Odense Universitetshospital. Dette er især relevant hos patienter, hvor der er bestyrket mistanke om PNS, men hvor det ikke er lykkedes at påvise et antistof ved de nævnte rutineanalyser.
Ved T-cellemedierede PNS, hvor antistoffet er rettet mod et intracellulært antigen, er effekten af immunterapi meget begrænset. Det er afgørende at identificere canceren og iværksætte relevant kirurgisk og onkologisk behandling, hvilket kan medføre neurologisk stabilisering. Som immunterapi kan forsøges intravenøs højdosismethylprednisolonbehandling med peroral aftrapning over 1-3 måneder og hos enkelte desuden cyclophosphamidbehandling [21, 27].
I tilfælde af B-cellemedieret PNS, hvor autoantistoffet er rettet mod et antigen i celleoverfladen eller en synapse, er førstelinjebehandling ofte intravenøs methylprednisolonbehandling (1 g/dag i 3-5 dage) efterfulgt af oral højdosisprednisolonbehandling (1 mg/kg) eventuelt kombineret med terapeutisk plasmaudskiftning (5-7 behandlinger over 10-14 dage) og/eller intravenøst givet immunglobulin (2 g/kg fordelt over fem dage). Oftest er der god effekt af behandlingen. Ved manglende effekt eller recidiv kan anti-CD20-behandling (rituximab) overvejes. Ligesom ved T-cellemedieret PNS er det afgørende at behandle den underliggende cancer [28].
Ved PNS er associationen mellem klinisk fænotype, antistof og underliggende cancer i løbet af de seneste år blevet bedre belyst, samtidig med at der jævnligt bliver opdaget nye neurale autoantistoffer relateret til PNS. De opdaterede diagnostiske kriterier med PNS-Care-score kan forbedre både diagnostik og behandling af patienter med PNS. Kendskab til begrænsningerne ved autoimmun diagnostik af PNS er afgørende for korrekt udredning og fortolkning. Klinikken er afgørende, og fund af antistoffer skal altid tolkes i den kliniske kontekst.
Korrespondance Anna Christine Nilsson. E-mail: Christine.Nilsson@rsyd.dk
Antaget 7. februar 2023
Publiceret på ugeskriftet.dk 13. marts 2023
Interessekonflikter ingen. Forfatternes ICMJE-formularer er tilgængelige sammen med artiklen på ugeskriftet.dk
Artikelreference Ugeskr Læger 2023;185:V03220204
Anna Christine Nilsson, Matias Ryding, Charlotte Aaberg Poulsen & Morten Blaabjerg
Ugeskr Læger 2023;185:V03220204
Diagnosis of paraneoplastic neurologic syndromes (PNS) requires an understanding of the clinical, immunologic and oncologic heterogeneity. The 2004 PNS criteria were partially outdated due to advances in the field, and updated consensus criteria for PNS have been proposed in 2021, including the PNS-Care score for assessment of PNS probability. Furthermore, knowledge on the limitations of autoantibody testing is crucial to ensure accurate interpretation. This review presents the updated diagnostic criteria for PNS, in a Danish context.