Patofysiologiske mekanismer og behandlingsstrategier i atrieflimren

Lisa Amalie Gottlieb1, Jacob Mosgaard Larsen2, Dominik Linz1 & Uffe Jakob Ortved Gang3
Hovedbudskaber
Multiple faktorer bidrager til patogensen ved atrieflimren (AF).
Komorbiditet er hyppig hos patienter med AF, og behandling heraf bør prioriteres højt, da mange komorbiditeter påvirker AF-patogenesen.
AF-behandling bør tilpasses de patofysiologiske mekanismer, men udviklingen af værktøjerne hertil er ufuldstændig.
Atrieflimren (AF) er den hyppigste kardiale arytmi hos voksne [1]. Livstidsrisikoen er omtrent en ud af tre [1]. Incidensen af AF forventes at stige i fremtiden pga. længere levetid i befolkningen [2]. AF fører til hjertebanken, træthed, åndenød og svimmelhed samt nedsat livskvalitet og risiko for hjertesvigt, iskæmisk stroke og død [2]. Patogenesen bag AF er kompleks og involverer en heterogen række af patologiske mekanismer (Tabel 1). Idet AF medfører ændringer i hjertemuskelvævets struktur og elektrofysiologi som vedligeholder AF og forhindrer spontan konvertering til sinusrytme, er tidlig erkendelse af AF med mulighed for forebyggelse og behandling væsentlig [4].
De seneste årtiers forskning har ført til en øget indsigt i de patofysiologiske mekanismer bag AF. Der er dog enighed om, at en komplet forståelse af AF-patogenesen hos den enkelte patient mangler, og at en individualiseret strategi i forhold til forebyggelse og behandling er nødvendig [2].
I denne artikel gennemgås de patofysiologiske mekanismer bag AF, de hyppigste komorbiditeter og risikofaktorer der bidrager til patogenesen, samt potentielle forebyggende indsatser og behandlinger.
AF er en kompleks og ukoordineret hurtig elektrisk aktivitet i atrievævet [7]. Det kræver en trigger (udløsende komponent) og et substrat, for at AF hhv. opstår og opretholdes i hjertemuskelvævet [4]. Strukturændringer i atrievævet og dysfunktion af hjertemuskelcellernes ionkanaler og calciumhåndtering bidrager både til at en trigger er til stede, og at der sker en substratdannelse [4]. Ydre faktorer, såsom autonom nerveaktivitet og stræk, modulerer ligeledes trigger og substrat [8, 9].
Når atrierne er i AF, roterer en kompleks aktiveringsbølge igennem atrievævet, som aktiverer det samme væv gentagne gange (reentry) (Figur 1) [7]. Vævsområder, hvor den elektriske overledning (dvs. aktivering) er blokeret, muliggør reentry. En sådan blokering opstår ved anatomiske forhindringer, såsom arvæv, eller ved lokaliserede forskelle i overledningshastigheden eller i atriecellernes refraktærperiode.
Haïssaguerre et al påviste i 1998, at fokal impulsdannelse (ektopi) i hjertemuskelvævet i lungevenerne kan udløse AF hos patienter med paroksystisk AF, dvs. AF-episoder af kortere varighed end en uge [10]. Det ændrede den nonfarmakologiske behandling af AF til at involvere elektrisk isolation af lungevenerne ved ablation.
AF medfører ændringer i atriernes struktur, herunder ophobning af fedt og kollagen (arvæv), hvilket forsinker overledningen gennem vævet [4]. En langsom overledning af den elektriske aktivitet øger risikoen for reentry (Figur 1). Ligeledes kan overledning af et ektopisk impuls (f.eks. fra lungevenerne til venstre atrium) være afhængig af blokerende arvæv [11].
AF forårsager ændringer i ionkanalerne, hvilket fører til en kortere refraktærperiode [4]. Hvis forkortelsen er heterogen i atrievævet, øger det risikoen for en blokering af overledningen og dermed for reentry. Det betyder, at AF skaber forhold i hjertevævet, der afstedkommer AF. Tidlig genoprettelse af sinusrytme (rytmekontrol) efter AF-diagnose er i et multicenterstudie med 2.789 patienter påvist at nedsætte risikoen for kardiovaskulær død og iskæmisk stroke [12].
Stræk
Stræk af atrievævet og lungevenerne fører til AF [9]. Dette skyldes især åbning af strækaktiverede ionkanaler, hvilket forkorter atriecellernes refraktærperiode og udløser fokale impulsdannelser [9]. Stræk øges ved stigende volumen og tryk i atriet. Store atrier påvist ved f.eks. ekkokardiografi er derfor en risikofaktor for AF. AF fører i sig selv til dilatation af atrierne [9].
Autonom nerveaktivitet
Både parasympatisk og sympatisk nerveaktivitet kan udløse og opretholde AF. Samtidig aktivitet af begge autonome nervegrene forårsager flere impulsdannelser i lungevenerne end ved aktivitet af blot den ene gren [8]. Nogle patienter med symptomatisk paroksystisk AF tilskriver situationer med overvejende parasympatisk eller sympatiske aktivitet, som værende udløsende for deres AF-symptomer, f.eks. postprandial fase (parasympathicus) eller psykisk stress (sympathicus) [13]. Øget parasympatisk aktivitet tillægges ofte årsagen til AF, som opstår om natten. Kropsstilling og natligt vejrtrækningsmønster er dog også af betydning [9].
Iskæmi
Iskæmi, hypoxi og efterfølgende reperfusion i atrievævet medfører ændringer i atriecellernes refraktærperiode og ektopi i lungevenerne [14]. I dagene efter akut myokardieinfarkt opstår der AF hos 2-21% af patienterne [9]. Både øget belastning og stræk af atriet pga. ventriklens nedsatte pumpefunktion samt iskæmisk involvering af de atriale koronarkar bidrager her til AF [15].
Fibrose
Et samspil mellem stræk, inflammation og vækstfaktorer udløser ophobning af kollagen mellem atriemuskelcellerne (fibrose) [9]. Fibrose i atrievævet er associeret med flere komorbiditeter, men også AF selv medfører fibrose [16]. Fibrose forstyrrer den elektriske overledning, hvilket kan føre til reentry [4]. Det er derfor ikke overraskende, at jo mere atrial fibrose, jo lavere sandsynlighed for vedvarende sinusrytme efter ablationsbehandling [17].
Inflammation
Systemisk og lokal atrial inflammation er associeret med AF. Den elektriske overledning er ofte forsinket og refraktærperioden afkortet [14]. AF er også associeret med komorbiditeter, såsom svær overvægt, som forårsager systemisk inflammation. Et samspil finder sted, da AF selv udløser inflammation, som derved opretholder AF [14]. I tilfælde af lokal atrial inflammation nedsætter antiinflammatorisk behandling risikoen for AF [14].
Fedtvæv
Mængden af fedtvæv omkring hjertet (epikardialt fedt) er associeret med øget incidens og varighed af AF [18]. Epikardialt fedtvæv udskiller cytokiner, vækstfaktorer og hormoner, som påvirker atriecellernes ionkanaler, så den elektriske overledning gennem vævet forsinkes. Derudover udløser inflammation og strukturel hjertesygdom ophobning af fedtceller mellem hjertemuskelcellerne, som ligeledes interfererer mod den elektriske overledning, så risikoen for reentry stiger.
Genetisk prædisposition
Monogenetisk årsag til AF er sjælden, men er beskrevet i familier med mutation i gener for natrium- og kaliumkanaler [19]. Polygenetiske ændringer medvirker derimod til AF. Polymorfisme i genet for transkriptionsfaktoren PITX2 øger risikoen for AF [19]. PITX2 er nødvendig for den embryologiske dannelse af lungevenernes hjertemuskelvæv [19].
Alkohol
Alkoholindtag er associeret med akut indtrædende AF [20]. Selv et dagligt alkoholindtag svarende til en halv genstand øger risikoen for AF [20]. De underliggende mekanismer er relateret til lungevenerne, idet et randomiseret humant studie viser, at alkoholinfusion afkorter refraktærperioden i lungevenerne, uden påvirkning andre steder i venstre atrium [20].
Patienter med AF har i gennemsnit fem komorbiditeter [22]. AF uden komorbiditet er sjælden selv hos patienter < 60 år [23]. Tabel 2 viser incidensen af de hyppigste komorbiditeter og livsstilsfaktorer, samt hvorledes disse påvirker AF-patogenensen. Arteriel hypertension sameksisterer ofte med AF, og ætiologien bag hypertension, såsom øget sympatisk nerveaktivitet og aktivering af renin-angiotensin-aldosteron-systemet (RAAS), er i sig selv proarytmisk for AF. Obstruktiv søvnapnø er en ofte udiagnosticeret komorbiditet, som er associeret med både hypertension, svær overvægt og AF. I tilfælde af hjertesvigt, herunder svigt med bevaret pumpefunktion, er AF ofte til stede, og en fælles patologisk mekanisme i både ventrikler og atrier er blevet foreslået [2].
Potentielle behandlingsstrategier relateret til AF patogenese diskuteres nedenfor (Tabel 1, Tabel 2 og Figur 2). Der henvises desuden til den nationale AF behandlingsvejledning, også for retningslinjer i forhold til forebyggelse af AF-komplikationer, herunder iskæmisk stroke (jf. antikoagulation) og hjertesvigt (jf. frekvensregulering).
Farmakologi
Rytmekontrol i AF forsøges ofte behandlet farmakologisk ved brug af klasse IC- og III-antiarytmika. Klasse IC-antiarytmika, såsom flecainid og propafenon, hæmmer natriumkanalen i hjertemuskelcellernes ydre membraner, hvilket påvirker aktionspotentialet og den elektriske overledning. Sinusrytme opnås hos omtrent halvdelen af patienterne tre timer efter akut behandling med klasse IC-antiarytmika [2]. Amiodaron og sotalol er derimod klasse III antiarytmika, som forlænger den refraktære periode ved hæmning af kalium-kanaler. Konvertering til sinusrytme opnås hos lidt under halvdelen af patienter inden for behandlingens første dage [2]. Derudover medvirker betablokkere (klasse II) til at opretholde sinusrytme hos nogle patienter med AF efter DC-konvertering [24]. Dog mangler den ellers gavnlige effekt af betablokkere muligvis hos patienter med hjertesvigt med nedsat pumpefunktion ved samtidig AF [2].
RAAS-antagonisme kan hæmme fibrosedannelsen i hjertet og er associeret med lavere risiko for senere udvikling af AF hos patienter med arteriel hypertension end behandling med andre antihypertensiva såsom betablokkere og diuretika, trods lignende blodtryksfald [25]. Da fibrose bidrager til opretholdelsen af AF [4], eksisterer der muligvis et behandlingspotentiale af AF ved at forhindre eller eliminere atrial kollagenophobning.
Ablation
Kateterbaseret ablation som første behandlingsstrategi er påvist bedre at kunne forhindre både AF-forekomst og -progressionen heraf end farmakologisk antiarytmisk behandling [5, 6]. Ablation tilbydes til patienter, der har AF med symptomer, både som førstevalgsterapi og efter forsøg med farmakologisk behandling. Den eneste ablationsstrategi, som anbefales på nuværende tidspunkt, er lungeveneisolation [2]. Ved lungeveneisolation ablateres (destruktion ved opvarmning, frysning eller elektroporese) vævet omkring lungevenerne i venstre atrium. Der er tale om en elektrisk isolation, hvor ektopi fra lungevenerne ikke længere kan overledes til atriet og initiere AF.
Lungeveneisolation har en dokumenteret succesrate på 60-80% hos patienter med paroksystisk AF [14]. Hos den resterende andel af patienterne ses oftest en reduktion i AF-byrde målt ved indopererede monitoreringsdevices [26]. Succesraten af lungeveneisolation er lavere hos patienter med persisterende AF. AF-patogenesen hos disse patienter udgøres med stor sandsynlighed af andre faktorer end lungevenektopi, såsom et lokaliseret arytmogent substrat. Ablation af fibrotiske områder i venstre atrium i tillæg til lungeveneisolation forbedrer dog ikke succesraten hos patienter, som har persisterende AF [27].
Ændring i autonom nerveaktivitet er forsøgt med ablation af nerveganglierne, der sidder tæt på lungevenerne [14]. Tidligere studier viste en effekt på AF, men også høj komplikationsrate. Ablativ denervering af sympatiske nerver i nyrerne i tillæg til lungeveneisolation har en bedre succesrate hos patienter med paroksystisk AF med ukontrolleret hypertension end lungeveneisolation alene [28]. Den antiarytmiske effekt kan skyldes en reduktion i sympatisk og RAAS-aktivitet, men også i blodtryk.
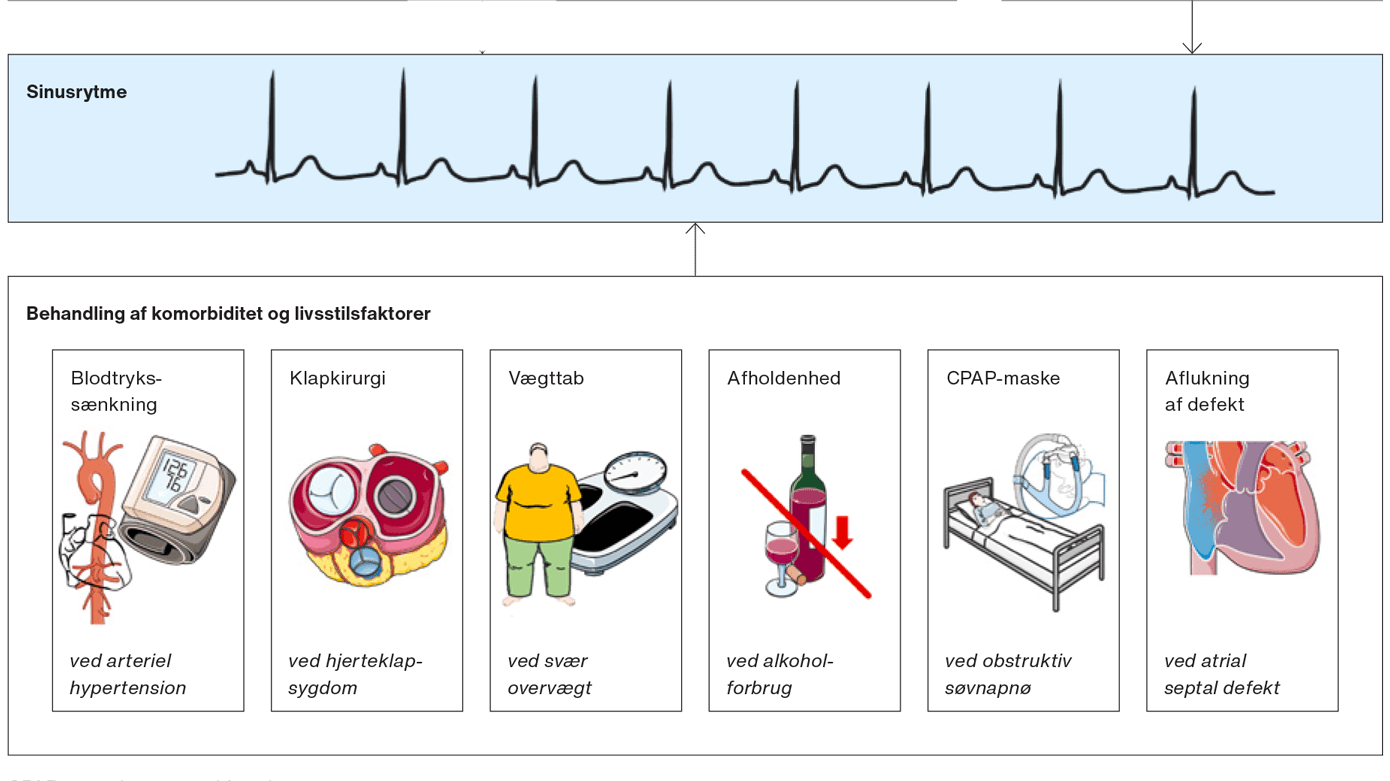
Behandling af komorbiditet og livsstilsfaktorer
Komorbiditet og livsstilsfaktorer nedsætter sandsynligheden for sinusrytme efter ablationsbehandling [2]. Disse tilstande udløser patofysiologiske processer, som påvirker atrievævets struktur og elektrofysiologi, hvorved AF selvopretholdes. Komorbiditetsbehandling og optimering i livsstil kan medvirke til at forhindre denne onde cirkel. Det anbefales, at blodtrykket er ≤ 130/80 mmHg hos patienter med hypertension og AF [2]. Natlig maske med continuous positive airways pressure (CPAP) kan forhindre AF-forekomst hos patienter med AF [2]. Vægttab hos overvægtige patienter med AF medfører en reduktion i forekomsten af AF [29]. Ydermere er afholdenhed hos patienter med AF og et ugentligt alkoholforbrug ≥ 10 genstande påvist at nedsætte forekomsten af AF [21]. Moderat, men ikke hyppig og ekstrem, fysisk aktivitet synes også forbundet med mindre forekomst af AF [2]. Optimering af patientens samtlige komorbiditeter og livsstilsfaktorer nedsætter AF-forekomsten fem år efter ablativ lungeveneisolation [30]. En multifaktoriel behandlingsstrategi af AF med fokus på komorbiditet og livsstilsfaktorer bør således forsøges hos den enkelte patient [2].
AF er en hyppig sygdom, som både nedsætter livskvaliteten og øger mortaliteten. AF-patogenesen er kompleks og involverer multiple faktorer, såsom atrialt stræk, autonom nerveaktivitet og inflammation. Da AF oftest sameksisterer med andre sygdomme og tilstande, bør man have mistanke om komorbiditet hos alle patienter med AF. Komorbiditetsbehandling og optimeret livsstil bør tilstræbes hos den enkelte patient, da disse tilstandes patofysiologiske processer direkte påvirker AF-patogenesen. Tidlig rytmekontrol ved ablationsbehandling virker til at forhindre AF-forekomst og sygdomsprogression.
Korrespondance Lisa Amalie Gottlieb. E-mail: gottlieb@sund.ku.dk
Antaget 28. juni 2023
Publiceret på ugeskriftet.dk 4. september 2023
Interessekonflikter Der er anført potentielle interessekonflikter. Forfatternes ICMJE-formularer er tilgængelige sammen med artiklen på ugeskriftet.dk
Referencer findes i artiklen publiceret på ugeskriftet.dk
Artikelreference Ugeskr Læger 2023;185:V03230140
Lisa Amalie Gottlieb, Jacob Mosgaard Larsen, Dominik Linz & Uffe Jakob Ortved Gang
Ugeskr Læger 2023;185:V03230140
Atrial fibrillation (AF) is the most common cardiac arrhythmia. AF reduces the patients’ quality of life and increases the risks of heart failure, ischaemic stroke, and death. The aetiology of AF is complex and involves multiple pathophysiological pathways. Comorbidities often coexist in patients with AF and contribute to the pathogenesis. The pathogenesis, the most common comorbidities, and possible individualized treatment options of AF are discussed in this review.