Statusartikel
Platformsforsøg
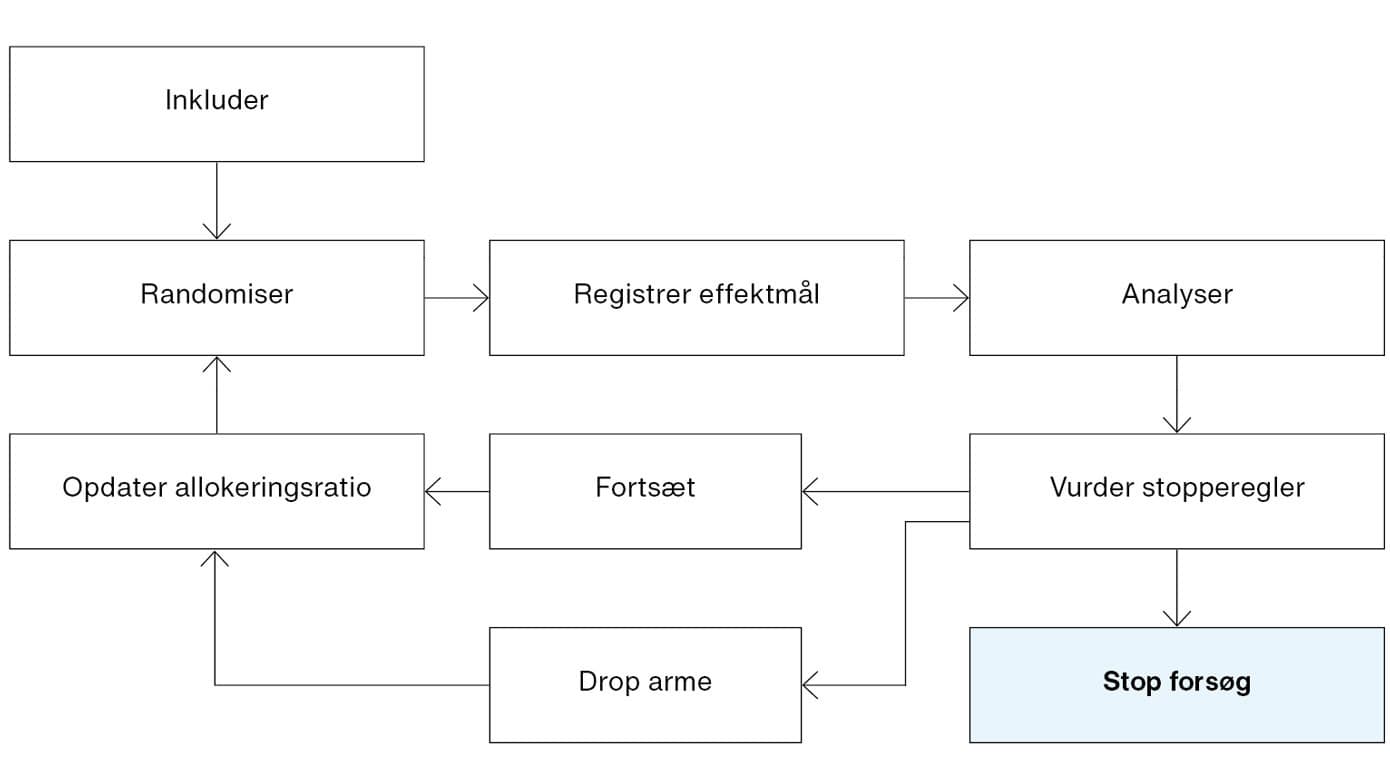
Anders Perner1, 2, Maj-Brit N. Kjær1, Hans-Christian Thorsen-Meyer1, Benjamin S. Kaas-Hansen1, 3, Marie W. Munch1, Marie O. Collet1, Camilla R. L. Bruun1, Aksel K. G. Jensen3, Theis Lange3, Trine Albertsen4, Claus Duedal Pedersen4, Lone M. Poulsen5, Ole Mathiesen2, 5, Anne C. Brøchner6, Thomas Strøm7, 8, Lars W. Andersen9, Steffen Christensen10, Bodil S. Rasmussen11, Olav L. Schjørring11, Mathias Maagaard4, Morten Hylander Møller1, 2 & Anders Granholm1
9. okt. 2023
12 min.