Stevens Johnsons syndrom og toksisk epidermal nekrolyse

Diljit Kaur-Knudsen, Claus Zachariae & Simon Francis Thomsen
Stevens-Johnsons syndrom (SJS) og toksisk epidermal nekrolyse (TEN) er akutte mukokutane sygdomme, der primært udløses af lægemidler. De to sygdomme har samme ætiologi, patogenese og histologiske træk, men repræsenterer to forskellige manifestationer i hver sin ende af det samme sygdomsspektrum, hvorfor de ofte omtales som én sygdom. De adskiller sig alene fra hinanden ud fra andelen af kropsoverfladen, der er involveret. Sygdommene er sjældne, men har høj mortalitet [1].
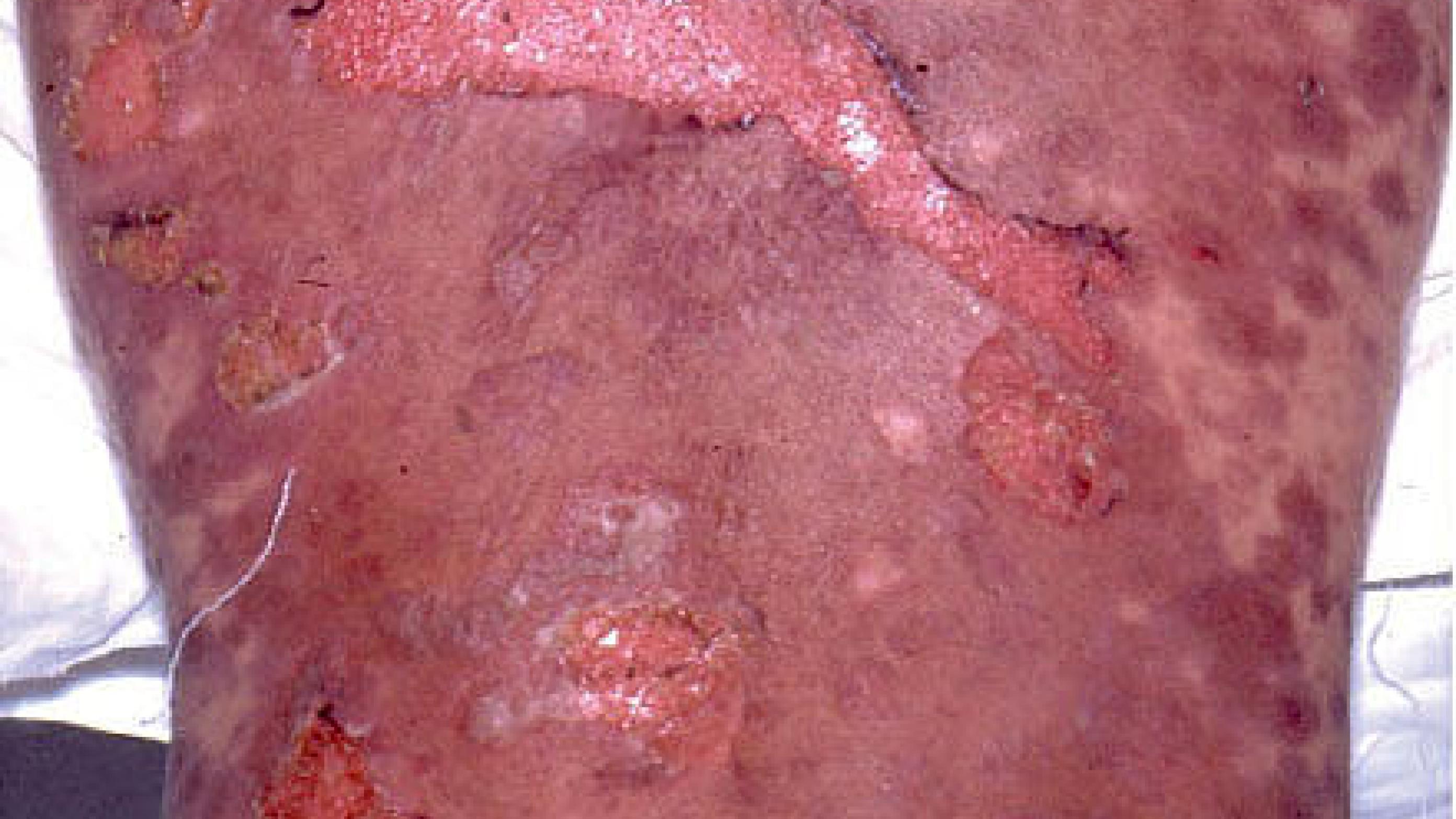
Både SJS og TEN karakteriseres ved slimhindeaffektion og potentiel livstruende epidermal nekrolyse, der er forårsaget af autoimmun apoptose af keratinocytterne og resulterer i separation af epidermis fra dermis, hvilket symptomatisk svarer til en andengradsforbrænding [2, 3]. TEN er den sværeste form med en epidermal løsning på > 30% af kropsoverfladen og en mortalitet på 20-25%, mens SJS er en mildere form, der er karakteriseret ved < 10% epidermal løsning og en mortalitet på 5-12%. Tilstande med epidermal løsning af 10-30% karakteriseres som overlap mellem SJS og TEN [4]. Ved alle tre tilstande er der i de fleste tilfælde også slimhindeaffektion og systemiske symptomer (Tabel 1). Forud for symptomdebut har patienterne ofte prodromale influenzalignende symptomer [1]. Affektionen af huden begynder ofte som erytematøse, makulære læsioner, der hurtigt kan udvikle sig til papler, vesikler og bullae. Disse kan flyde sammen og dermed give epidermal nekrolyse med positivt Nikolskys tegn til følge (huden skrider ved let tryk) [4]. Dette resulterer i øget tab af væske og risiko for hypovolæmi, hypotension og infektion. Ofte vil der også være affektion af håndfladerne og fodsålerne med erytem, ødem og ømhed. Slimhindeaffektionen kan involvere øjne, næse, mund, vagina, urethra, gastrointestinalkanalen og luftvejene og give symptomer i form af konjunktivitis, vulvovaginitis/balanitis, urinretention og stomatitis [1]. Årsagen til den høje dødelighed er sepsis og multiorgansvigt [5]. Det er kendt, at alder ≥ 40 år, malignitet, takykardi ≥ 120 slag/min, S-karbamidniveau > 10 mmol/l, blodsukkerniveau > 14 mmol/l og S-bikarbonatniveau < 20 mmol/l er associeret med dårlig prognose for TEN [6]. Symptomerne ses ofte 1-3 uger efter udsættelse for det udløsende lægemiddel. Diagnosen er klinisk og bør endeligt bekræftes ved hudbiopsi. Differentialdiagnoserne er bl.a. staphylococcal scalded skin syndrome, akut generaliseret eksematøs pustolose og paraneoplastisk pemfigus
[7, 8].
Mange forskellige præparater har været mistænkt for at indgå i patogenesen, men en håndfuld anses for at være højrisikopræparater, herunder antibiotika, antiepileptika, allopurinol og nonsteroide antiinflammatoriske stoffer (NSAID) (Tabel 2) [9]. Behandling med multiple farmaka kan gøre det vanskeligt at identificere den udløsende faktor, men den kronologiske medicinanamnese kan hjælpe til opklaringen. Symptomerne anses for at være en hypersensitiv reaktion over for visse lægemidler, men regelrette allergitest er vanskelige at udføre pga. risikoen for at fremprovokere et nyt tilfælde af SJS/TEN. På nuværende tidspunkt findes der ikke tilfredsstillende parakliniske undersøgelser til afklaring af lægemiddelsensitiviteten. Patienterne skal derfor undgå det mistænkte præparat resten af livet.
Genetik spiller sandsynligvis en vigtig rolle for, hvem der udvikler SJS og TEN, da det kun er en lille del af alle de patienter, der får højrisikopræparater, som afficeres. Der er fundet association med alleler i humant leukocytantigen (HLA)-regionen. Flere forskellige HLA-alleler indgår afhængigt af præparat
og patientens etnicitet. F.eks. er der fundet en association mellem HLA-B*5801 og allopurinol samt HLA-B*1501 og antiepileptika hos asiater [10]. Også i den europæiske population er der fundet sammenhæng mellem genetiske variationer i HLA-regionen og SJS/TEN [11].
Da både SJS og TEN er potentielt livstruende sygdomme, er hurtig diagnose og påbegyndelse af behandling essentielt for at reducere morbiditet og mortalitet. Den udløsende faktor skal hurtigst muligt identificeres og seponeres. Dette kan især være en udfordring hos ældre patienter, som får meget medicin, eller hos patienter, som er sat i behandling med flere forskellige præparater på samme tid. Alle ikkelivsvigtige medikamina bør seponeres. Vigtigst er det at identificere medicinpræparater, der er påbegyndt behandling med inden for de seneste fire uger [8, 12].
Behandlingen er først og fremmest symptomatisk. Ved svær hudaffektion overflyttes patienterne til en brandsårsafdeling tidligt i forløbet, da behandlingen i disse tilfælde ikke adskiller sig væsentligt fra behandlingen af brandsårspatienter [5]. Behandlingen kan også foregå på en intensivafdeling, hvor man har erfaring i behandling af patienter med svær hudaffektion i samarbejde med dermatologer. Pga. risiko for tab af store mængder væske og elektrolytter gennem den afficerede hud er sufficient væskeindgift og hæmodynamisk stabilisering afgørende for at forhindre hypovolæmi og hypotension. Den optimale mængde af væskeindgift er individuel og afhænger af udbredelsen af hudaffektionen, diurese og daglige vægtmålinger. Sår skal behandles, og sekundærinfektioner i hud, blod og urin skal udelukkes, ligesom patienterne skal til hyppige oftalmologiske kontroller ved øjenaffektion. Store bullae bør punkteres og løsnet hud fjernes for at mindske risikoen for infektion. Munden skylles med NSAID og/eller antimykotika. Sufficent kalorieindtag skal sikres i form af flydende ernæringsdrik, da indtagelse af fast føde ofte er smertefuld
[1, 5, 13]. Den vigtigste behandling er således primært symptomatisk, idet sygdommene er selvbegrænsende, når det udløsende præparat er seponeret. Den optimale systemiske behandling af SJS og TEN er kontroversiel, idet der fortsat mangler klar evidens fra store randomiserede studier om de forskellige behandlingsmuligheder, hvilket vanskeliggøres af den sjældne forekomst af sygdommene. Det er i øvrigt vigtigt at være opmærksom på, at hvis patienten vanligvis får anden peroral medicin, kan optagelsen af denne blive kompromitteret af en evt. slimhindepåvirkning i gastrointestinalkanalen.
På trods af, at systemisk kortikosteroid har været standardbehandling for SJS i mange år, er behandlingen omdiskuteret, da den har været associeret med længerevarende indlæggelse og risiko for bivirkninger og infektioner hos de behandlede patienter sammenlignet med patienter, som ikke blev behandlet med systemisk kortikosteroid [14]. På den anden side er der dog også flere studier, som viser, at de nævnte risici primært ses ved langvarig behandling eller systemisk kortikosteroid givet sent i forløbet, hvorimod tidlig og korterevarende behandling muligvis kan stoppe sygdomsprogressionen [15]. De fleste studier med resultater både for og imod behandling med systemisk steroid er dog baseret på få observationer, hvorfor evidensen på nuværende tidspunkt ikke er overbevisende. Desuden verserer der fortsat diskussion i litteraturen om den optimale dosis, om behandlingen bør gives oralt eller intravenøst, over hvor lang tid behandlingen bør nedtrappes, og om behandlingen evt. bør gives som pulsterapi for at undgå langtidsbivirkningerne [14, 15].
Intravenøse immunglobuliner (IVIG) indeholder antistoffer, der kan hæmme keratinocytternes apoptose og dermed bremse sygdomsprogression af SJS og TEN [16, 17]. I flere ikkerandomiserede studier har man påvist, at IVIG-behandlingen stopper yderligere epidermal løsning og nedsætter mortaliteten [17-19]. I andre studier har man ikke fundet nogen overbevisende effekt af behandlingen [20, 21]. I en nyligt publiceret metaanalyse af 17 studier fandt man ikke en klinisk fordel ved IVIG-behandling, men ingen af de inkluderede studier var dog randomiserede [22].
Ciclosporin er et immunsupprimerende middel, som i casestudier har vist sig at være gavnligt til behandling af SJS og TEN [23]. Større randomiserede kontrollerede studier er dog nødvendige for at klarlægge ciclosporins rolle i behandlingen af disse sygdomme.
Der bliver fortsat forsket i nye behandlinger af SJS/TEN, men da sygdommene er sjældne, er kontrollerede randomiserede studier vanskelige at gennemføre. Foreløbige cases om behandlinger med granulocytkolonistimulerende faktor (G-CSF) og tumornekrosefaktor (TNF)α-hæmmere viser dog
lovende resultater:
G-CSF fremmer regeneration af huden ved hurtigere reepitelialisering [24]. G-CSF har i enkelte casestudier haft god effekt hos patienter med TEN og neutropeni [24-26]. Hypotesen er, at G-CSF kan øge antallet af neutrofile celler og dermed fremme reepitelialiseringen, da neutrofile celler har en positiv effekt på sårheling. Fremtidlig forskning må afklare effektivitet, bivirkninger og mekanisme ved brug af præparatet hos patienter med SJS/TEN [27].
TNFα-hæmmere som eksempelvis infliximab har i nyere cases vist sig at have en positiv effekt ved TEN [28, 29]. I immunhistokemiske undersøgelser er der fundet forekomst af TNFα i dermale og epidermale celler hos patienter med TEN. TNFα giver cytotoksisk skade på keratinocytter og kan derfor muligvis indgå i apoptosen af keratinocytterne [30]. På nuværende tidspunkt må behandlingen dog betragtes som eksperimentel, indtil der foreligger flere studier på
området.
SJS og TEN er potentielt livstruende hudsygdomme, som primært udløses af lægemidler. Tidlig diagnose og seponering af det udløsende lægemiddel er vigtig. Behandlingen er først og fremmest symptomatisk og ved udtalt epidermal nekrolyse adskiller den sig ikke væsentligt fra behandlingen af brandsårspatienter. Strategien for systemisk behandling er kontroversiel, men eksperimentelle behandlinger er med god effekt afprøvet hos enkelte patienter; der afventes flere studier inden for dette område med henblik på fremtidige behandlingsmuligheder.
Endnu findes der ikke nok viden på det farmakogenetiske område, til at patienterne kan stratificeres på baggrund af genetiske markørdata forud for ordination af højrisikopræparater. Yderligere forskning og viden inden for området kan dog med tiden gøre denne form for testning mulig og dermed reducere forekomsten af SJS- og TEN-tilfælde.
KORRESPONDANCE: Diljit Kaur-Knudsen, Hud- og allergiafdelingen, Gentofte
Hospital, Niels Andersens Vej 65, 2900 Hellerup. E-mail: diljit.kaur@regionh.dk
ANTAGET: 4. december 2012
FØRST PÅ NETTET: 6. maj 2013
INTERESSEKONFLIKTER: ingen.
Stevens-Johnson syndrome and toxic epidermal necrolysis are acute mucocutaneous diseases primarily due to drug intake. The diseases are characterised by the separation of epidermis from dermis which can be life-threatening. Mortality is often caused by sepsis and multiple organ failure. The most common drugs involved are antibiotics, antiepileptic medicine, allopurinol and nonsteroidal anti-inflammatory drugs. Besides withdrawing the suspected drug the treatment is mainly symptomatic. A number of systemic treatments have been suggested including systemic corticosteroids, intravenous immunoglobulins, cyclosporine, granulocyte colony stimulating factor and tumour necrosis factor-alpha inhibitors although they remain controversial.
Burns T, Breathnach S, Cox N et al. Rook‘s textbook of Dermatology. 8. ed. West Sussex: Wiley-Blackwell, 2010:76.8-76.22.
Paul C, Wolkenstein P, Adle H et al. Apoptosis as a mechanism of keratinocyte death in toxic epidermal necrolysis. Br J Dermatol 1996;134:710-4.
Abe R, Shimizu T, Shibaki A et al. Toxic epidermal necrolysis and Stevens-Johnson syndrome are induced by soluble Fas ligand. Am J Pathol 2003;162:1515-20.
Bastuji-Garin S, Rzany B, Stern RS et al. Clinical classification of cases of toxic epidermal necrolysis, Stevens-Johnson syndrome, and erythema multiforme. Arch Dermatol 1993;129:92-6.
Schulz JT, Sheridan RL, Ryan CM et al. A 10-year experience with toxic epidermal necrolysis. J Burn Care Rehabil 2000;21:199-204.
Bastuji-Garin S, Fouchard N, Bertocchi M et al. SCORTEN: a severity-of-illness score for toxic epidermal necrolysis. J Invest Dermatol 2000;115:149-53.
Mockenhaupt M. The current understanding of Stevens-Johnson syndrome and toxic epidermal necrolysis. Expert Rev Clin Immunol 2011;7:803-13.
Mukasa Y, Craven N. Management of toxic epidermal necrolysis and related syndromes. Postgrad Med J 2008;84:60-5.
Roujeau JC, Kelly JP, Naldi L et al. Medication use and the risk of Stevens-Johnson syndrome or toxic epidermal necrolysis. N Engl J Med 1995;333:1600-7.
Phillips EJ, Mallal SA. Pharmacogenetics of drug hypersensitivity. Pharmacogenomics 2010;11:973-87.
Genin E, Schumacher M, Roujeau JC et al. Genome-wide association study of Stevens-Johnson syndrome and toxic epidermal necrolysis in Europe. Orphanet J Rare Dis 2011;6:52.
Bygum A, Andersen KE. Toksisk epidermal nekrolyse. Ugeskr Læger 2006;168:2645-9.
Zajicek R, Pintar D, Broz L et al. Toxic epidermal necrolysis and Stevens-Johnson syndrome at the Prague Burn Centre 1998-2008. J Eur Acad Dermatol Venereol 2012;26:639-43.
Michaels B. The role of systemic corticosteroid therapy in erythema multiforme major and Stevens-Johnson syndrome: a review of past and current opinions. J Clin Aesthet Dermatol 2009;2:51-5.
Kardaun SH, Jonkman MF. Dexamethasone pulse therapy for Stevens-Johnson syndrome/toxic epidermal necrolysis. Acta Derm Venereol 2007;87:144-8.
French LE, Trent JT, Kerdel FA. Use of intravenous immunoglobulin in toxic epidermal necrolysis and Stevens-Johnson syndrome: our current understanding. Int Immunopharmacol 2006;6:543-9.
Viard I, Wehrli P, Bullani R et al. Inhibition of toxic epidermal necrolysis by blockade of CD95 with human intravenous immunoglobulin. Science 1998;282:490-3.
Mittmann N, Chan B, Knowles S et al. Intravenous immunoglobulin use in patients with toxic epidermal necrolysis and Stevens-Johnson syndrome. Am J Clin Dermatol 2006;7:359-68.
Prins C, Kerdel FA, Padilla RS et al. Treatment of toxic epidermal necrolysis with high-dose intravenous immunoglobulins: multicenter retrospective analysis of 48 consecutive cases. Arch Dermatol 2003;139:26-32.
Shortt R, Gomez M, Mittman N et al. Intravenous immunoglobulin does not improve outcome in toxic epidermal necrolysis. J Burn Care Rehabil 2004;25:246-55.
Bachot N, Revuz J, Roujeau JC. Intravenous immunoglobulin treatment for Stevens-Johnson syndrome and toxic epidermal necrolysis: a prospective noncomparative study showing no benefit on mortality or progression. Arch Dermatol 2003;139:
33-6.
Huang YC, Li YC, Chen TJ. The efficacy of intravenous immunoglobulin for the treatment of toxic epidermal necrolysis: a systematic review and meta-analysis. Br J Dermatol 2012;167:424-32.
Valeyrie-Allanore L, Wolkenstein P, Brochard L et al. Open trial of ciclosporin treatment for Stevens-Johnson syndrome and toxic epidermal necrolysis. Br J Dermatol 2010;163:847-53.
de Sica-Chapman A, Williams G, Soni N et al. Granulocyte colony-stimulating factor in toxic epidermal necrolysis (TEN) and Chelsea & Westminster TEN management protocol [corrected]. Br J Dermatol 2010;162:860-5.
Jarrett P, Rademaker M, Havill J et al. Toxic epidermal necrolysis treated with cyclosporin and granulocyte colony stimulating factor. Clin Exp Dermatol 1997;22:146-7.
Pallesen KA, Robinson S, Toft P et al. Successful treatment of toxic epidermal necrolysis/Stevens-Johnson syndrome overlap with human granulocyte colony stimulating factor: a case report. Acta Derm Venereol 2012;92:212-3.
Ang CC, Tay YK. Hematological abnormalities and the use of granulocyte-colony-stimulating factor in patients with Stevens-Johnson syndrome and toxic epidermal necrolysis. Int J Dermatol 2011;50:1570-8.
Worswick S, Cotliar J. Stevens-Johnson syndrome and toxic epidermal necrolysis: a review of treatment options. Dermatol Ther 2011;24:207-18.
Scott-Lang V, Tidman M, McKay D. Toxic epidermal necrolysis in a child successfully treated with infliximab. Pediatr Dermatol. doi: 10.1111/pde.12029. 16. okt 2012 (epub ahead of print).
Paquet P, Paquet F, Al SW et al. Immunoregulatory effector cells in drug-induced toxic epidermal necrolysis. Am J Dermatopathol 2000;22:413-7.