Tarmultralydskanning ved kronisk inflammatorisk tarmsygdom

Jacob Wium Bjerrum1, 2, Johan Ilvemark1, 2, Jakob Benedict Seidelin1, 2 & Rune Wilkens2, 3
Hovedbudskaber
Tarm-UL-skanning (TUL) er en noninvasiv, hurtig, billig og veltålt undersøgelsesmodalitet, der let kan appliceres i klinisk praksis og understøtte klinisk beslutningstagning i realtid.
TUL kan benyttes til monitorering af sygdomsaktivitet og behandlingsrespons ved kroniske inflammatoriske tarmsygdomme.
TUL som selvstændig modalitet muliggør vurdering af sygdomslokalisation, -aktivitet, komplikationer og ændringer heraf.
Crohns sygdom (CD) og colitis ulcerosa (UC) er kroniske inflammatoriske tarmsygdomme (IBD), hvor overvågning af sygdomsforløb og behandlingsrespons er afgørende for prognosen [1]. Monitorering af patienterne foregår i dag med endoskopi, MR-skanning af tyndtarmen og afføringsprøver. Patienterne finder alle undersøgelserne ubehagelige, og både endoskopi og MR-skanning er invasive, tidskrævende, bekostelige og kræver forberedelse. De er således ikke ideelle som repetitive overvågningsmodaliteter [2]. Tarm-UL-skanning (TUL) er derimod en noninvasiv, hurtig, billig og veltålt undersøgelsesmodalitet, der ikke kræver forberedelse af patienterne og derfor let kan appliceres i klinisk praksis som point-of-care og dermed understøtte klinisk beslutningstagning i realtid [3].
I modsætning til vanlige biomarkører for aktivitet (CRP og calprotectin) leverer TUL information om inflammationens lokalisering, udstrækning, sværhedsgrad og evt. komplikationer (stenoser, fistler og abscesser), og i modsætning til skopi giver TUL information om transmural sygdom. På den baggrund vinder TUL i stigende grad indpas i overvågning af sygdomsaktivitet hos børn [4], gravide [5] og andre patientgrupper, hvor skopi og MR-skanning er mindre hensigtsmæssige. Dertil kommer, at TUL har vist sig at kunne prædiktere behandlingsresponset tidligt i forløbet ved håndteringen af både CD [6] og UC [7-9], ligesom man med den kan identificere nydiagnosticerede patienter med IBD, der har høj risiko for fremtidig hospitalisering, behov for terapiintensivering og operation [10]. Sammenlignet med endoskopi [11] og MR-skanning [12, 13] har TUL desuden vist sig at have samme præcision, når det kommer til vurderingen af sygdomsaktiviteten ved IBD, hvorfor TUL nu i internationale guidelines anbefales på lige fod med disse modaliteter til monitoreringen af IBD-aktivitet [14].
TUL er således ved at blive etableret som en afgørende faktor i processen med at evaluere den rigtige behandling til den rigtige patient på det rigtige tidspunkt. Med nærværende artikel ønsker vi at give et indblik i, hvordan TUL udføres, anvendes og implementeres i den kliniske gastroenterologiske hverdag.
TUL kræver en middel til god UL-skanner med to prober. En abdominal ultralydsprobe til overblik over tarmens anatomi, patologi og dybereliggende forandringer og en mellemfrekvent probe (indeholdende 5-8 MHz som minimum) med højere opløsning. Denne er essentiel til undersøgelse af tyndtarmen, tyktarmen og mesenteriet. Til undersøgelsen bruges todimensional brightness mode, mens colour Doppler signaling (CDS) kan benyttes til vurdering af blodgennemstrømningen i tarmen, og kontrastforstærket UL anvendes til identifikation af abscesser og fistler.
Der kræves ingen forberedelse som faste, udrensning eller oralt indgivet kontrast, og undersøgelsen tager typisk 5-15 min afhængigt af evt. patologi. Ofte kan undersøgelsen foretages samtidig med konsultationen og tilmed benyttes pædagogisk mhp. at øge patienternes sygdomsforståelse og dermed forhåbentlig komplians. Patienten undersøges liggende fladt på ryggen. Sigmoideum identificeres nemt i venstre fossa og hele colon gennemskannes systematisk, hvorefter terminale ileum identificeres i højre fossa og skannes. Ideelt set skannes tarmen både i tvær- og længdesnit. Tyndtarmsgebetet skannes med proben horisontalt og systematiske kraniokaudale bevægelser [15].
Den mest anale del af rectum kan være svær at vurdere transabdominalt. Hvis en helt lav proktitis eller perianal sygdom ved CD ønskes visualiseret, kan dedikeret transperineal UL-skanning anvendes [16].
Venstre colonfleksur kan ligeledes være udfordrende at visualisere. Dyb abdominal inspiration medfører, at fleksuren ofte kan visualiseres under venstre ribbenskurvatur eller ved venstre flanke, hvor også interkostalt indblik kan foretrækkes. Ved betydeligt adipøse patienter medfører det ofte, at man med den mellemfrekvente probe ikke kan visualisere tarmen sufficient, og undersøgelsens kvalitet reduceres dermed.
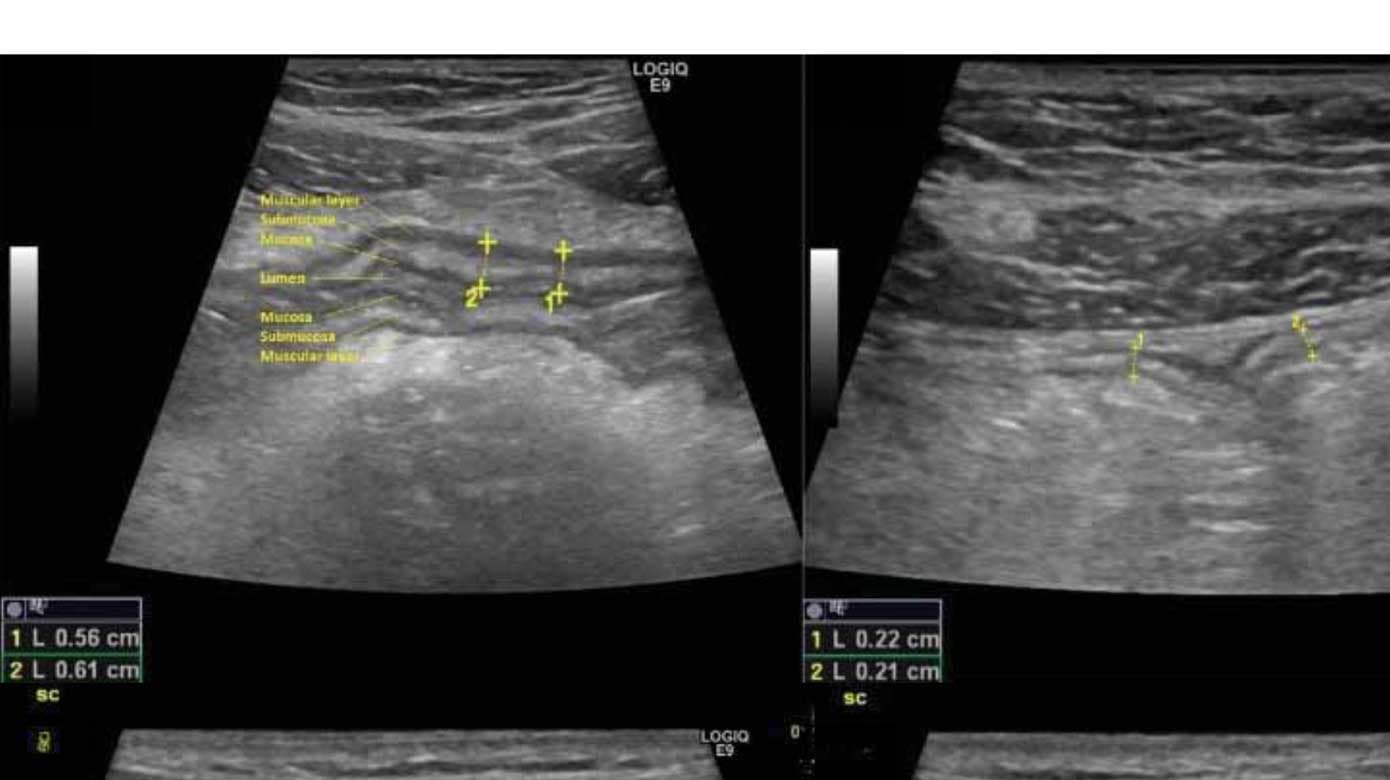
Ved hjælp af TUL identificerer man minimum tre lag i tarmvæggen, og de fremtræder visuelt som »sort-hvid-sort« (Figur 1 A) [17]: Det første hypoekkoiske (dvs. sorte/mørke) lag modsvarer mucosa, mens det næste hyperekkoiske (dvs. hvide/lyse) lag er submucosa. Til sidst ses endnu et hypoekkoisk lag – muscularis propria. Den normale tykkelse af tarmvæggen (bowel wall thickness (BWT)) er < 2,0 mm i både tyk- og tyndtarm (Figur 1 B) [15]. Inflammation vil øge BWT til > 3,0 mm ved både CD og UC (Figur 1 A). Andre mål for inflammation er forstyrret lagdeling i tarmvæggen (dvs. tab af bowel wall stratification) (Figur 1 C + D) samt øgning i CDS (Figur 1 E + F). Endelig ses mesenterial fedtproliferation (Figur 1 C + D) mest udbredt ved CD og forstørrede lymfeknuder i krøset. Stenoser, fistler og abscesser identificeres også ved TUL, og det er muligt at kvantificere en eventuel præstenotisk dilatation [18]. Der er udviklet forskellige aktivitetsscorer, hvoraf International Bowel UltraSound Segmental Activity Score (IBUS-SAS) er valideret til CD [19], mens Milan Ultrasound Criteria (MUC) er valideret til UC [20]. Begge er signifikant korreleret til endoskopiske fund. På den baggrund har vi udviklet en systematisk deskriptiv standardrapport, som indeholder de essentielle informationer og resultater af en TUL ved både CD og UC (Tabel 1).
Sygdomsaktivitet er defineret for CD ved en IBUS-SAS > 25 (sensitivitet 82%, specificitet 100%) [11] og for UC ved en MUC > 6,2 (sensitivitet 85%, specificitet 94%) [20]. Den tilhørende transmurale remission (TR) er defineret ved BWT ≤ 3 mm og en normal CDS, hvorimod et terapeutisk respons er defineret ved en reduktion i BWT på > 25% eller > 2,0 mm eller ved en reduktion på > 1,0 mm sammen med et fald på 1 i CDS-score [3]. Definitionerne for TR og respons er baseret på en konsensusrapport og kræver yderligere validering ved fremtidige studier.
De hidtidige studier viser dog tydeligt TUL’s anvendelighed ved monitoreringen af sygdomsaktivitet og behandlingseffekt. Således har et studie vist, at man vha. TUL efter blot 48 t. kan forudsige, hvorvidt patienter, som er indlagt med svær akut UC og behov for i.v. givet kortikosteroid, vil respondere på behandlingen [7]. Kommende prospektive behandlingsstudier forventes derfor at kunne bidrage til en evidensbaseret beslutning om fortsat behandling med kortikosteroid eller skift til rescue-terapi med infliximab eller alternativt kolektomi tidligere end efter gældende praksis. Hos patienter med moderat til svær UC kan TR allerede konstateres efter to ugers konventionel behandling [8]. Disse tidlige forandringer muliggør overvejelser om optimering eller skift i terapistrategi tidligere, end hvad vi er vant til. Vi er således på vej mod den rigtige medicin til den rigtige patient på et tidligt tidspunkt.
Hos patienter med CD synes TUL derimod først at vise et respons efter fire uger, mens TR kan ses efter otte uger [21, 22]. Den terminale ileum responderer og heler langsommere end colon. Der skal derfor udvises større tålmodighed ved behandlingen af CD, specielt ved ileal involvering. Dog tyder manglende TR efter 14 ugers behandling med infliximab (IBUS-SAS > 32, sensitivitet 73%, specificitet 70%) [23] på at være prædiktiv for manglende endoskopisk remission efter et års behandling og kan dermed skabe mulighed for tidlig terapioptimering efter induktionsbehandlingen med infliximab. Desuden synes TR at være associeret med signifikant forbedret langtidsprognose sammenlignet med klinisk [24] og endoskopisk remission med lavere indlæggelsesrater (9% vs. 28%, p < 0,001), mindre behov for kirurgi (0% vs. 10%, p < 0,01) og højere steroidfri kliniske remissionsrater (96% vs. 75%, p < 0,01) [25]. Dette taler direkte ind i Selecting Therapeutic Targets in Inflammatory Bowel Disease-behandlingsmålene (STRIDE II) for CD [26], hvor TR opfattes som et adjuverende behandlingsmål. Det første studie, hvor TUL med central reading bruges som det primære endepunkt, er således allerede publiceret [22], og mange nye er planlagt.
TUL har en høj sensitivitet (78-90%) og specificitet (91-97%) for identifikation af stenoser, fistler og abscesser [27], men data på behandlingsrespons i patientkohorter med penetrerende sygdom er yderst sparsomme. Der er dog begyndende evidens for den postoperative overvågning med TUL, hvor BWT < 3 mm og et normalt calprotectinniveau (< 50 μg/g) identificerer 74% af alle uden recidiv et år efter operation [28].
Globalt set bliver TUL stadig anvendt sparsomt, men interessen for uddannelse blandt gastroenterologer og gastropædiatere er stærkt stigende. Dette er begrundet med stigende international standardisering, overbevisende evidens og en etableret international uddannelse.
I Italien og Tyskland er TUL en integreret del af den gastroenterologiske speciallægeuddannelse, men ikke i Danmark og resten af verden. Siden 2016 har the International Bowel Ultrasound (IBUS) Group tilbudt en samlet TUL-uddannelse bestående af tre moduler [17]. På første modul læres teorien bag TUL, og samtidig præsenteres kursisterne for de nødvendige tekniske færdigheder via hands-on på patienter med patologi, hvorved også fortolkningsfærdighederne øves [29]. Kurset følges op af modul to med fire uger på et ekspertcenter for TUL, hvor færdighederne udvikles med demonstration, supervision og refleksiv feedback. Endelig bygges mere avanceret teori på, og der afsluttes med en certificerende eksamen på modul tre. I Danmark har vi allerede nu succesfuldt uddannet mere end 25 læger via IBUS.
To af forfatterne til denne artikel har taget initiativ til at oprette både Copenhagen Intestinal UltraSound (CIUS) – et nationalt og internationalt trænings- og forskningscenter – og IBUS Nordic – et samarbejde med Norge, Sverige og Finland om en nordisk TUL-uddannelse, der følger IBUS’ curriculum. Implementering af TUL i Danmark er dog langt mere end uddannelse, og i Figur 2 ses øvrige afgørende forudsætninger for at opnå komplet implementering [30], hvor det ultimative mål er udbredt national tilgængelighed på højt niveau samt integration med speciallægeuddannelsen i intern medicin, gastroenterologi og hepatologi. Til det formål er der også nedsat et UL-udvalg under Dansk Selskab for Gastroenterologi og Hepatologi. Udvalget har udviklet en hvidbog, der nøje beskriver planen for implementeringen af abdominal UL-skanning i speciallægeuddannelsen, og som angiver uddannelsesniveauet, der forventes opnået af en færdiguddannet speciallæge. Gennemføres desuden en TUL-uddannelse i IBUS- eller IBUS Nordic-regi, vil den herved opnåede TUL-kompetence kunne sidestilles med kompetencer i andre specialiserede undersøgelser, der kun udføres af dedikerede subspecialiserede læger. TUL-uddannelsen kan således sammenlignes med den påkrævede endoskopiske oplæring, men hvor det kun er med en efterfølgende subspecialisering, at man kan udføre mere avanceret endoskopi som endoskopisk retrograd kolangiopankreatografi og endoskopisk UL-skanning.
TUL er nationalt og internationalt ved at blive etableret som et af de mest betydningsfulde kliniske værktøjer inden for behandlingen og kontrollen af patienter med inflammatoriske tarmsygdomme. Med den nuværende evidens kunne monitoreringsstrategier for UC og CD med anvendelse af TUL se ud som skitseret i Figur 3. Sådanne monitoreringsstrategier vil skulle valideres, men de kunne potentielt være afgørende for, at den enkelte patient fik den rigtige behandling på det rigtige tidspunkt, og dermed kunne behandlingsmålene opnås hurtigere, og der kunne skabes mulighed for at ændre naturhistorien for IBD. Fremtiden med TUL som en del af speciallægeuddannelsen synes derfor uundgåelig. Som i andre specialer vil sygeplejerskeudført rutine-UL-skanning kunne være en oplagt ambulant funktion for fremtidens tiltagende pressede IBD-ambulatorier.
Korrespondance Jacob Wium Bjerrum. E-mail: jacob.wium.bjerrum@regionh.dk
Antaget 4. december 2023
Publiceret på ugeskriftet.dk 5. februar 2024
Interessekonflikter ingen. Forfatternes ICMJE-formularer er tilgængelige sammen med artiklen på ugeskriftet.dk
Referencer findes i artiklen publiceret på ugeskriftet.dk
Artikelreference Ugeskr Læger 2024;186:V07230479
doi: 10.61409/V07230479
Open Access under Creative Commons License CC BY-NC-ND 4.0
Jacob Wium Bjerrum, Johan Ilvemark, Jakob Benedict Seidelin & Rune Wilkens
Ugeskr Læger 2024;186:07230479 doi: 10.61409/V7230479
Intestinal ultrasound (IUS) is non-invasive, fast, cheap, and well-tolerated and requires no preparation and is thus applicable as a point-of-care monitoring tool of inflammatory bowel disease (IBD). Evidence suggests that IUS is comparable to other standard monitoring modalities, i.e., endoscopy, MRI, calprotectin, and C-reactive protein and might be more accurate in predicting response to treatment at an early stage consequently allowing for timely optimised treatment. This review finds that integrating IUS as the standard of care in every IBD outpatient clinic and as the primary outcome in future medical trials seems inevitable.