Ny medicin booster forskning i demens
Den længe ventede medicinske behandling af tidlig Alzheimers sygdom er godkendt i USA, men endnu ikke i Europa. Effekten er begrænset, og bivirkningerne kan være alvorlige. Alligevel vækker den optimisme.

Han står ved den stærkt trafikerede Ringgade i Aarhus. En høj, ældre herre i en ternet skjorte. Uden overtøj i januar måned. Han kigger sig lidt forvirret omkring og spørger en kvinde, der kommer forbi: »Hvor finder jeg Sjællandske Bank? Jeg skal i banken.« Året er 2023. Sjællandske bank blev i 1984 til Kronebanken, som i øvrigt heller ikke eksisterer længere.
Manden har Alzheimers sygdom. Inde bag den rynkede pande hersker kaos i en hjerne, som indtil for bare få år siden husede en stor personlighed. Og ingen medicin kan redde manden fra den sygdom, som får hans hjerne til at skrumpe.
På verdensplan er manden en ud af 55 mio. menneske, ramt af demens – heraf har 70 pct. Alzheimers sygdom. I Danmark har omkring 85.000 mennesker demens og tallet vokser i takt med den demografiske udvikling.
I januar i år blev lægemidlet lecanemab ganske vist godkendt til behandling af Alzheimers sygdom i USA. Men det er ikke relevant for manden ved Ringgaden i Aarhus, for lægemidlet er ikke godkendt i Europa – og har i øvrigt kun effekt på patienter med tidlige tegn på sygdommen.
Men lægemidlet har vakt stor opmærksomhed, fordi det er første gang, lægerne kan ordinere en behandling til patienter med tidlig Alzheimers sygdom, som kan forsinke sygdomsudviklingen.
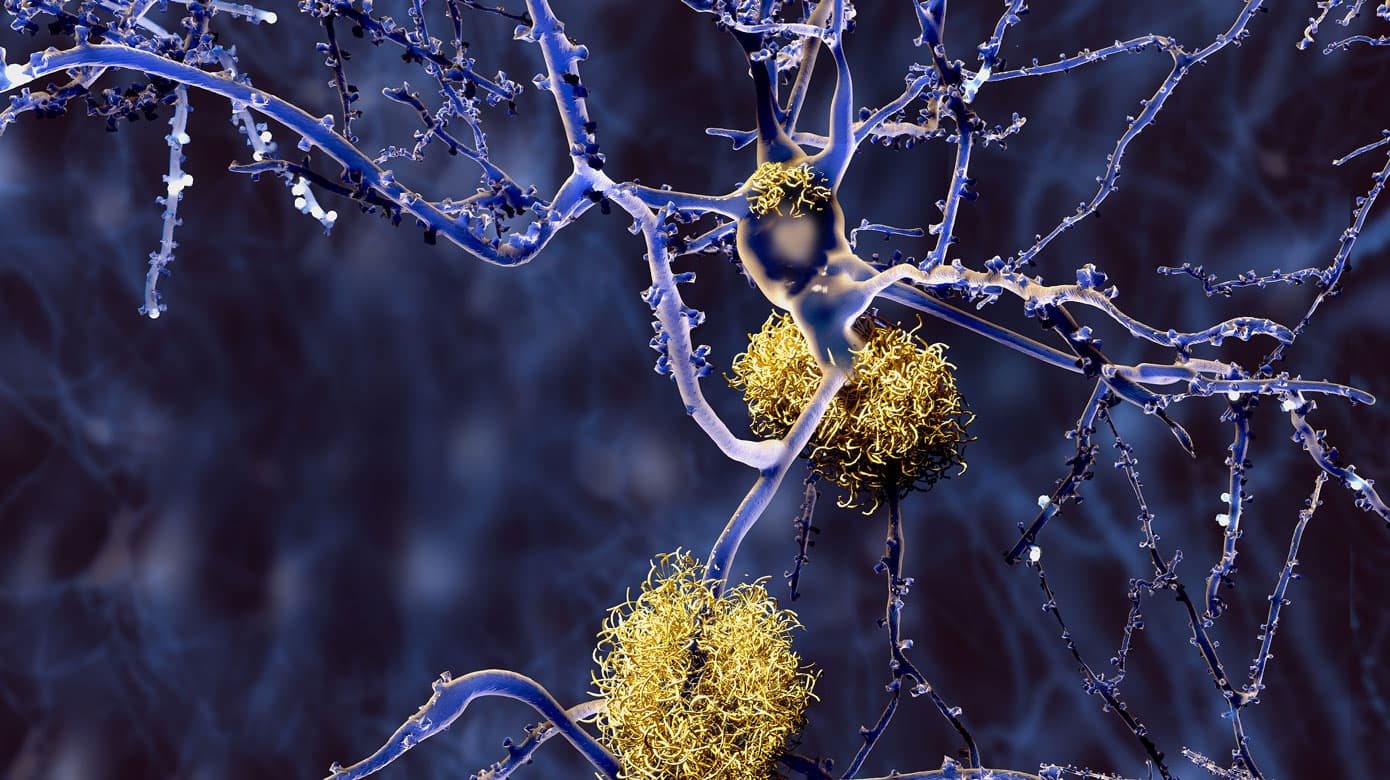
Det nye lægemiddel, som er et immunstof, nedbryder forstadierne til de såkaldte plaques, som er ophobninger af proteinstoffet beta-amyloid. Plaques menes at spille en afgørende rolle i sygdomsudviklingen.
Det er et gennembrud. Men også en skuffelse. For effekten er lille, og bivirkninger med hævelser og blødninger i hjernen kan være alvorlige.
Alligevel har lanceringen medført optimisme blandt mange forskere på området og banet vejen for en bedre sygdomsforståelse som afsæt for ny diagnostik og nye behandlinger.
Det fortæller professor i demenssygdomme og forskningsleder Steen Hasselbalch fra Nationalt Videnscenter for Demens, som netop har deltaget i en international konference om Alzheimers og Parkinsons sygdomme i Göteborg i Sverige.
»Det hele handler om, at vi skal identificere patienter tidligt, så de kan få det her medicin – så forskningen er til dels drevet af medicinalindustrien, men samtidig er hele den udvikling med til at øge vores forståelse af, hvad der sker i hjernen,« siger han.
Tilfældigvis var det netop i Sverige, at en familie i Norrland uforvarende satte skub i forskningen i en behandling for over tyve år siden.
En bekymret distriktslæge i Umeå undrede sig i 1999 over 11 familiemedlemmer, som alle havde fået Alzheimers sygdom i en ung alder. Gennemsnitsalderen for deres sygdomsdebut var 57 år. Han kontaktede derfor den svenske overlæge Lars Lannfelt, som dengang arbejdede på Karolinska og var kendt for sin viden om demens og genetikken og de molekylære mekanismer bag neurodegenerative sygdomme.
Lars Lannfelt rejste til Umeå og undersøgte familien. Han fandt hos dem en særlig mutation, som senere fik navnet »den arktiske mutation«. Mennesker med det gen danner flere protofibriller, som er forstadierne til plaques. I modsætning til plaques er protofibrillerne opløselige, og derfor førte opdagelsen Lars Lannfelt på sporet af en behandling. Han ville finde et stof, som kunne nedbryde protofibrillerne, inden de blev til klumper af uopløselige sammenklistrede tråde i plaques.
Der fulgte flere end tyve års forskning, og undervejs blev Lars Lannfelt professor på Uppsala Universitet, inden han og hans team udviklede den nye immunmodulerende medicin, som nu er lanceret.
Forud for lanceringen præsenterede forskerne i november sidste år i San Francisco under stor opmærksomhed resultaterne af et randomiseret forsøg med 1.795 deltagere mellem 50 og 90 år. De havde tidlige tegn på Alzheimers sygdom og blev delt i to grupper. I den ene gruppe fik alle 10 mg medicin via infusion hver 14. dag i 18 måneder. Kontrolgruppen fik placebo. Og medicinen virkede. Patienterne dannede ikke så mange protofibriller, så der var mindre ophobning af amyloid i deres hjerner sammenlignet med kontrolgruppen, og behandlingen bremsede svækkelse af hukommelse og tænkning med 27%.
Forskellen på dem, der fik medicin, og kontrolgruppen var dog ikke så stor: Begge grupper startede på ca. 3,2 point på den 18-pointsskala, som anvendes til at vurdere kognitivt og praktisk funktionsniveau. De behandlede endte på 4,4 point, mens kontrolgruppen endte på 4,9 point. Omsat til udvikling af sygdom svarer det til, at de behandlede var fem måneder længere om at nå samme demensstadie som kontrolgruppen over et interval på 18 måneder.
Kritikerne – for dem er der også – siger, at selvom resultatet er statistisk signifikant, er det ikke »klinisk signifikant«. Eller som leder af Nationalt Videnscenter for Demens, Gunhild Waldemar, udtrykker det:
»Vi vil gerne se en effekt, der rent faktisk er til at få øje på«.
Studiet er beskrevet i en artikel I New England of Medicine.
»Hvis du har en gruppe patienter med tau i blodet, så har halvdelen udviklet demens inden for de kommende seks år. Så det er en god markør« Professor Steen Hasselbalch, Nationalt Videnscenter for Demens
Selvom effekten var lille, og vi ikke står med et mirakelmiddel mod Alzheimers sygdom, er forsøget interessant, mener Steen Hasselbalch.
»For første gang ser vi her evidens for en sammenhæng mellem at fjerne amyloid og forsinke kognitivt forfald«.
Dermed underbygger forsøget en gammel og omdiskuteret hypotese om en af de grundlæggende mekanismer bag sygdommen. Hypotesen hedder »amyloidkaskaden« og blev i 1992 formuleret af professor John Hardy fra University College i London og den amerikanske professor Gerald Higgins fra Harvard.
Hypotesen siger, at Alzheimers sygdom opstår, når proteinet amyloid begynder at hobe sig op som plaques imellem hjernecellerne, neuronerne. Det fører til, at et andet proteinstof, tau, hober sig op inde i cellerne og filtrer sig sammen i såkaldte tangles. Proteinophobningerne forstyrrer cellernes stofskifte og kommunikation og resulterer i celledød. Begge proteiner dannes også i raske hjerner, så det er ophobningerne, plaques og tangles, som hører sygdommen til.
Hypotesen har været styrende for en stor del af forskningen og især lægemiddeludviklingen lige siden, at den kom frem, men har også været til stor diskussion.
For spørgsmålet er, hvorvidt beta-amyloid er den afgørende faktor i sygdomsudviklingen, sådan som hypotesen siger, eller om tau har en vigtigere rolle. Altså en slags hønen og ægget-diskussion.
Tau kan sprede sig ud til andre områder af hjernen, og ny forskning tyder på, at den spredning er afgørende for de symptomer, som patienten får. Derfor er tau også et mål for udvikling af både diagnostik og ny behandling.
Tvivlen på amyloids rolle skyldes, at der er gjort talrige forsøg på at udvikle midler, som kan fjerne amyloidophobninger, men alle er strandet på manglende evidens for klinisk effekt. Nogle midler kunne ganske vist fjerne amyloid, men havde ingen effekt på patienternes kognitive evner. Samtidig er det vist, at nogle mennesker kan have amyloidophobninger i hjernen livet igennem uden at udvikle Alzheimers sygdom.
Men de nye forskningsresultater har altså lagt en del af diskussionen ned, fortæller Steen Hasselbalch.
»Det ser ud til, at der er en tæt sammenhæng mellem amyloid og så de her tau-tangles. Det er gået fra hypotese til at være viden. Sygdommen starter med amyloid, så hvis du har for meget tau i hjernen, så må du også have amyloid«.
Rækkefølgen er vigtig for de forskere, som arbejder på at udvikle nye behandlinger, men også for at finde tidlige biomarkører for sygdommen. Og det er netop, hvad Steen Hasselbalch forsker i.
»Man kan have amyloid tyve år før, at man udvikler symptomer, og spørgsmålet er, om man kan gå rundt med amyloid hele livet uden at udvikle Alzheimers. Det kan man formentlig godt. Det er først, når vi også kan måle tau, at du er på vej til at udvikle sygdommen. Så med tau som biomarkør kan vi identificere dem, der er ved at udvikle demenssymptomer«, siger Steen Hasselbalch.
»Hvis du har en gruppe patienter med tau i blodet, så har halvdelen udviklet demens inden for de kommende seks år. Så det er en god markør«.
Biomarkører i blodprøver var et af de helt store samtaleemner på konferencen i Sverige, fortæller han. Hidtil har målinger af amyloid og tau ellers krævet test af spinalvæske og PET, men nu er det muligt at anvende blodprøver i stedet. Her markerer Sverige sig igen. Det er den svenske professor i neurologi, Oskar Hansson fra Lunds Universitet, som står bag nye diagnostiske metoder med afsæt i biomarkører fra blodprøver.
»Drømmen er, at du kan screene folk tidligt ud fra en blodprøve, så du kan se, om de er på vej til at udvikle Alzheimers. Og ved at nøjes med blodprøver kan vi jo teste mange flere, hurtigere og billigere«, siger han.
Steen Hasselbalch advarer dog imod at koble specialisterne helt ud af ligningen og overlade diagnostikken til praktiserende læger – eller hjemmetest. Det kan resultere i fejldiagnoser eller i, at andre sygdomme ikke opdages.
»Hvis du har en patient med positiv amyloid og let forhøjede værdier af tau også, så ville du sige, at det er nok Alzheimers. Men det kan jo være, at patienten først vil få Alzheimers om flere år – og de problemer, patienten har her og nu, er relateret til en depression eller til stofskiftet. Så blodprøven kan ikke stå alene«.
Hypotesen om amyloid som drivende faktor i Alzheimers sygdom bygger på en forestilling om en lineær sygdomsudvikling, men den har ingen kunnet dokumentere – bortset fra, at amyloid ser ud til at komme før tau. Og meget tyder på, at sygdommen er mere kompliceret end som så.
»Selvom vi nu kan fjerne amyloid og se, at det har en effekt, er det ikke det fulde billede, fordi der er andre mekanismer i spil også«, siger Steen Hasselbalch.
»Vi har flere processer i gang: Beta-amyloid påvirker mitokondrierne inde i cellerne, så de fungerer dårligere og danner oxidativ stress, som beskadiger hjernecellernes DNA. Og så har vi neuroinflammation, som opstår, når immuncellerne reagerer på proteinophobningerne. Sammenhængen og rækkefølgen i de her processer kender vi ikke«.
Så måske er der flere faktorer, som tilsammen driver sygdomsudviklingen.
»Jeg tror, det er en kompleks sygdom, og vi kommer til at udvikle kombinationsbehandlinger, som retter sig mod de forskellige faktorer, sådan som vi kender det fra kræftområdet«, siger Steen Hasselbalch.
Mange nye studier og udvikling af ny medicin er da også målrettet andre dele af sygdommen end proteinophobningerne, og især neuroinflammation er der fokus på.
Trods fornyet optimisme, stor aktivitet i det internationale forskningsmiljø og flere end 140 nye lægemidler på vej, tror Steen Hasselbalch ikke på en egentlig kur for Alzheimers sygdom. Dertil er sygdommen for kompleks. Men han mener, at vi inden for en overskuelig årrække får lægemidler, som kan bremse sygdomsudviklingen og give patienterne flere gode leveår.
Det helt store behandlingsmæssige gennembrud afhænger dog af, at den største gåde bliver løst:
»Hvad trigger sygdommen?« – det er forskerne lige så uvidende om, som manden ved Ringgaden i Aarhus er uvidende om, hvor han befinder sig i tid og rum.
Casen er konstrueret ud fra en virkelig hændelse.
Fakta
200 sygdomme kan medføre demens. Alzheimers sygdom tegner sig for mindst halvdelen af alle demenstilfælde. Næsthyppigst er vaskulær demens, og mindre hyppig er frontotemporal demens, og Lewy body-demens, som hænger sammen med Parkinsons sygdom.
87.000 mennesker over 65 år eller derover lever med demens. Og antallet stiger støt med den demografiske udvikling.
8.000 får hvert år en demensdiagnose
5.000 patienter under 65 år har demens.